ಆಲ್ಕೋಹಾಲ್
ಈ ಲೇಖನ ಯಾವುದೇ ವಿಕಿಪೀಡಿಯ ಲೇಖನಕ್ಕೆ ಕೊಂಡಿಗಳನ್ನು (Interwiki links) ಹೊಂದಿಲ್ಲ. (ಜುಲೈ ೨೦೧೭) |

ರೆಪ್ಪೆಗಳಿಗೆ ಲೇಪಿಸುವ ಪುಡಿ ಎಂಬ ಅರ್ಥವುಳ್ಳ ಅರ್ಯಾಬಿಕ್ ಮೂಲಪದದಿಂದ ಆಲ್ಕೋಹಾಲ್ ಪದ ನಿಷ್ಪನ್ನಗೊಂಡಿದೆ. ಕಾಲ ಕ್ರಮೇಣ ಶುದ್ಧ ಮದ್ಯಸಾರಗಳಿಗೆಲ್ಲ ಆಲ್ಕೋಹಾಲ್ ಪದವನ್ನು ಅನ್ವಯ ಮಾಡಲಾಯಿತು. ಕಾರ್ಬನ್ ಪರಮಾಣುವಿನ ಸಂಯೋಗಶಕ್ತಿ (ವೇಲೆನ್ಸಿ) ನಾಲ್ಕು ಅಂದರೆ, ಅದು ನಾಲ್ಕು ಹೈಡ್ರೊಜನ್ ಅಥವಾ ಇತರ ಪರಮಾಣುಗಳನ್ನು ಹೊರಬಲ್ಲುದು. ಅಂಥ ಸಾವಯವ ವಸ್ತುಗಳು ಪರ್ಯಾಪ್ತವಾಗಿವೆ ಈ ತರಹದ ಕೆಲವು ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳಿವೆ. ಅವುಗಳಲ್ಲಿ ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳು ಸರಪಳಿಯಂತೆ ಒಂದಕ್ಕೊಂದು ಪೋಣಿಸಲ್ಪಟ್ಟಿರುತ್ತವೆ. ಈ ಪರಮಾಣುಗಳು ಚತುಸ್ಸಂಯೋಗಶಕ್ತಿಯನ್ನು ಸರಿದೂಗಿಸಲು ಅಗತ್ಯ ಸಂಖ್ಯೆಯ ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳಿರುತ್ತವೆ. ಇವೇ ಪ್ಯಾರಫಿನ್ ಹೈಡ್ರೊಕಾರ್ಬನ್ಗಳು ಅಥವಾ ಆಲ್ಕೇನ್ಗಳು. ಪ್ಯಾರಫಿನ್ ಅಣುವಿನಲ್ಲಿರುವ ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳ ಬದಲು, ಅಷ್ಟೇ ಸಂಖ್ಯೆಯ ಹೈಡ್ರಾಕ್ಸಿಲ್ (–OH) ಗುಂಪುಗಳಿದ್ದರೆ ಆಗ ಅದು ಆಲ್ಕೊಹಾಲ್ ಎನಿಸಿಕೊಳ್ಳುತ್ತದೆ.[೧][೨] ಆದ್ದರಿಂದ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಹೈಡ್ರಾಕ್ಸಿಪ್ಯಾರಫಿನ್ಗಳು ಎಂದು ಪರಿಗಣಿಸಬಹುದು. ಅವುಗಳ ಅಣುಸೂತ್ರ (CnH2n+1.OH) ಎಂದಾಯಿತು. ಆಲ್ಕೊಹಾಲಿನ ರಚನಾ ಸೂತ್ರವನ್ನು ಕೆಳಕಂಡಂತೆ ಸೂಚಿಸಬಹುದು.
| | | | -C-C-C-C-OH | | | |
ವರ್ಗೀಕರಣ
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೊಹಾಲ್ಗಳಲ್ಲಿ ನಾನಾ ಬಗೆಯುಂಟು.
- ಆಲ್ಕೊಹಾಲ್ನ ಒಂದು ಅಣುವಿನಲ್ಲಿರುವ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪುಗಳ ಸಂಖ್ಯೆ ಒಂದಾಗಿದ್ದರೆ ಮಾನೊಹೈಡ್ರಿಕ್.
- ಆಲ್ಕೊಹಾಲ್ನ ಒಂದು ಅಣುವಿನಲ್ಲಿರುವ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪುಗಳ ಸಂಖ್ಯೆ ಎರಡಾಗಿದ್ದರೆ ಡೈಹೈಡ್ರಿಕ್.
- ಆಲ್ಕೊಹಾಲ್ನ ಒಂದು ಅಣುವಿನಲ್ಲಿರುವ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪುಗಳ ಸಂಖ್ಯೆ ಮೂರಾಗಿದ್ದರೆ ಟ್ರೈಹೈಡ್ರಿಕ್
- ಆಲ್ಕೊಹಾಲ್ನ ಒಂದು ಅಣುವಿನಲ್ಲಿರುವ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪುಗಳ ಸಂಖ್ಯೆ ಅದಕ್ಕಿಂತ ಹೆಚ್ಚಾಗಿದ್ದರೆ ಪಾಲಿಹೈಡ್ರಿಕ್ ಎಂದು ವರ್ಗೀಕರಿಸಲಾಗುವುದು.
ಇದಕ್ಕೆ ಕ್ರಮವಾಗಿ ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ (CH3CH2OH), ಎಥಿಲೀನ್ ಗ್ಲೈಕಾಲ್ (CH2.OH.CH2OH), ಮತ್ತು ಗ್ಲಿಸರಾಲ್ (CH2OH.CHOH.CH2OH) ಉದಾಹರಣೆಗಳು. ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ವಿಂಗಡಿಸುವ ಇನ್ನೊಂದು ಕ್ರಮವಿದೆ. ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪನ್ನು ಧರಿಸಿರುವ ಕಾರ್ಬನ್ ಪರಮಾಣು, ನೇರವಾಗಿ ಎಷ್ಟು ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳನ್ನು ಹೊತ್ತಿದೆಯೆಂಬುದನ್ನು ಇದು ಅವಲಂಬಿಸಿದೆ. ನೇರ ಸಂಬಂಧವಿರುವ ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆ ಕನಿಷ್ಠಪಕ್ಷ ಎರಡಾಗಿದ್ದರೆ ಪ್ರೈಮರಿ ಆಲ್ಕೊಹಾಲ್ ಎನ್ನುವರು. ಇದಕ್ಕೆ ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ ಉದಾಹರಣೆ. ಅದರ ರಚನಾ ಸೂತ್ರದಿಂದ ಈ ಅಂಶ ವ್ಯಕ್ತವಾಗುತ್ತದೆ.
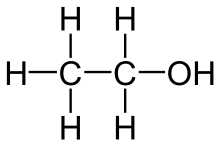
ಹೀಗೆಯೇ ಐಸೋಪ್ರೊಪೈಲ್ ಆಲ್ಕೊಹಾಲಿನ ರಚನೆಯನ್ನು ಪರಿಶೀಲಿಸಿದರೆ

ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪಿರುವ ಕಾರ್ಬನ್ ಪರಮಾಣುವಿನೊಡನೆ ಕೇವಲ ಒಂದು ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುವಿಗೆ ಮಾತ್ರ ಪ್ರತ್ಯಕ್ಷ ಸಂಬಂಧವಿದೆ. ಇಂಥ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಸೆಕೆಂಡರಿ ಎಂದು ಕರೆಯುವರು. ಕೆಲವು ಆಲ್ಕೊಹಾಲ್ನಲ್ಲಿ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗ್ರೂಪಿರುವ ಕಾರ್ಬನ್ ಹೈಡ್ರೊಜನ್ ರಹಿತವಾಗಿರುವುದುಂಟು. ಅವನ್ನು ಟರ್ಷಿಯರಿ ಎಂದು ಕರೆಯುತ್ತಾರೆ. ಇದಕ್ಕೆ ನಿದರ್ಶನವಾಗಿ ಟರ್ಷಿಯರಿ ಐಸೊಬ್ಯೂಟೈಲ್ ಆಲ್ಕೊಹಾಲನ್ನು ಹೆಸರಿಸಬಹುದು. ಅದರ ರಚನಾಸೂತ್ರದಿಂದ

ಇದು ವೇದ್ಯವಾಗುತ್ತದೆ. ಇದಲ್ಲದೆ ಕೆಳಕಂಡ ಜಾತಿಯ ಆಲ್ಕೊಹಾಲ್ಗಳೂ ಉಂಟು.
- ಸರಳ ಆಲಿಫ್ಯಾಟಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳು - ಉದಾ. ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ CH3-CH2-OH
- ಅಪರ್ಯಾಪ್ತ ಆಲಿಫ್ಯಾಟಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳು - ಉದಾ. ಅಲ್ಲೈಲ್ ಆಲ್ಕೊಹಾಲ್ CH2=CH-CH2OH
- ಆದೇಶಿತ ಆಲಿಫ್ಯಾಟಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳು - ಉದಾ. ಈಥೇನಾಲ್ ಅಮೀನ್ NH2-CH2-CH2OH
- ಆರೊಮ್ಯಾಟಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳು - ಉದಾ. ಬೆಂಜ಼ೈಲ್ ಆಲ್ಕೊಹಾಲ್ C6H5-CH2-OH
- ಆಲಿಸೈಕ್ಲಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳು - ಉದಾ. ಸೈಕ್ಲೊಹೆಕ್ಸನಾಲ್ C6H11-OH
- ಹೆಟಿರೊಸೈಕ್ಲಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳು - ಉದಾ. ಪರ್ಫೂರಿಲ್ ಆಲ್ಕೊಹಾಲ್ C4H3O-CH2OH
ನಾಮಕರಣ ವಿಧಾನ
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೊಹಾಲ್ ಕುಟುಂಬದ ಕಿರಿಯ ಸದಸ್ಯರನ್ನು (ಉದಾ: ಮೀಥೈಲ್ ಮತ್ತು ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ಗಳು) ಅವುಗಳ ಸಂಕ್ಷಿಪ್ತನಾಮದಿಂದ ಸೂಚಿಸಿರುತ್ತಾರೆ. ಅಂತರರಾಷ್ಟ್ರೀಯ ವ್ಯವಸ್ಥೆಯಾದ ಜಿನೀವ ಸಂಪ್ರದಾಯದ ಪ್ರಕಾರ, ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪನ್ನು ಧರಿಸಿರುವ ಕಾರ್ಬನ್ ಸರಣಿಯನ್ನು ಮೊದಲು ಗುರುತಿಸಿಕೊಂಡು, ಆ ರ್ಯಾಡಿಕಲ್ನ ಹೆಸರಿಗೆ ಆಲ್ ಎಂಬ ಪ್ರತ್ಯಯ ಸೇರಿಸಿ ಕರೆಯುವುದು ಪದ್ಧತಿ.[೩] ಹೈಡ್ರಾಕ್ಸಿಲ್ ಮತ್ತು ಇತರ ಗುಂಪುಗಳ ಸ್ಥಾನ ನಿರ್ದೇಶನಕ್ಕೆ ಸಂಖ್ಯೆಗಳನ್ನು ಬಳಸಲಾಗುವುದು. ಹೀಗೆ ಮಾಡುವಾಗ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗ್ರೂಪಿಗೆ ಕನಿಷ್ಠ ಸಂಖ್ಯೆಯನ್ನು ಕೊಡುವುದು ರೂಢಿ. ಉದಾಹರಣೆಗೆ ಐಸೊಬ್ಯೂಟೈಲ್ ಆಲ್ಕೊಹಾಲನ್ನು

2-ಮೀಥೈಲ್ ಪ್ರೊಪೆನಾಲ್-1 ಎಂದು ಕರೆಯಬೇಕಾಗುತ್ತದೆ.
ಆಲ್ಕೊಹಾಲ್ಗಳ ತಯಾರಿಕೆ
[ಬದಲಾಯಿಸಿ]ಆಲಿಫ್ಯಾಟಿಕ್ ಮಾನೊಹೈಡ್ರಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳ ತಯಾರಿಕೆ ಸಾರ್ವತ್ರಿಕ ವಿಧಾನಗಳು
1. ಆಲ್ಕೈಲ್ ಹ್ಯಾಲೈಡುಗಳ ಜಲವಿಶ್ಲೇಷಣೆಯಿಂದ: Rx + H2O → R.OH + Hx ನೀರು ಮಾತ್ರ ಇದ್ದರೆ ಕ್ರಿಯೆ ನಿಧಾನವಾಗುವುದು. ದುರ್ಬಲ ಕಾಸ್ಟಿಕ್ ಪೊಟ್ಯಾಷ್ ದ್ರಾವಣ ಅಥವಾ ತೇವವಾದ ಸಿಲ್ವರ್ ಆಕ್ಸೈಡ್ ಉಪಯೋಗಿಸಿದರೆ ಕ್ರಿಯೆಯನ್ನು ತ್ವರಿತಗೊಳಿಸಬಹುದು. ಇವು ಪ್ರತ್ಯಾಮ್ಲೀಯ ಪರಿವರ್ತಕಗಳು. ಆದ್ದರಿಂದ ಉತ್ಪತ್ತಿಯಾದ ಆಮ್ಲವನ್ನು ತಟಸ್ಥಗೊಳಿಸಿ ಆಲ್ಕೊಹಾಲಿನ ಉತ್ಪಾದನೆಯನ್ನು ಹೆಚ್ಚಿಸುವುವು. ಅನೇಕ ಆಲ್ಕೊಹಾಲ್ಗಳಿಗಿಂತ ಸಂಬಂಧಪಟ್ಟ ಆಲ್ಕೈಲ್ ಹ್ಯಾಲೈಡುಗಳೇ ಹೆಚ್ಚು ದುರ್ಲಭ. ಆದ್ದರಿಂದ ಈ ವಿಧಾನದ ವ್ಯಾಪ್ತಿ ಸೀಮಿತವಾಗಿದೆ.
2. ಅಪರ್ಯಾಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳಿಂದ: ಪ್ರಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದ ಸಂಪರ್ಕದಲ್ಲಿ ಹೈಡ್ರೊಕಾರ್ಬನ್ ಪರ್ಯಾಪ್ತಗೊಂಡು ಅದರ ಹೈಡ್ರೊಜನ್ ಸಲ್ಫೇಟ್ ಆಗುವುದು. ಅನಂತರ ಅದನ್ನು ಜಲವಿಶ್ಲೇಷಣೆಗೆ ಗುರಿಪಡಿಸಿದರೆ ಸಂಬಂಧಪಟ್ಟ ಆಲ್ಕೊಹಾಲ್ ಉಂಟಾಗುವುದು.
ಇಥಲೀನ್
ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್
3. ಆಲ್ಡಿಹೈಡುಗಳ, ಕೀಟೋನುಗಳ ಮತ್ತು ಎಸ್ಟರುಗಳ ಅಪಕರ್ಷಣದಿಂದ: ಇದಕ್ಕಾಗಿ ಹಲವಾರು ಅಪಕರ್ಷಣಕಾರಿಗಳು ಬಳಕೆಯಲ್ಲಿವೆ. ನವಜಾತ ಹೈಡ್ರೊಜನ್ ನೀಡುವ ಸೂಕ್ತ ಆಮ್ಲ (ಲೋಹದ ಜೋಡಿಯನ್ನು ಉಪಯೋಗಿಸುವುದು ಸರ್ವಸಾಮಾನ್ಯ), ಅವುಗಳ ಪೈಕಿ ಸತು ಮತ್ತು ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ, ಸತು ಅಥವಾ ಕಬ್ಬಿಣ ಮತ್ತು ಅಸಿಟಿಕ್ ಆಮ್ಲ, ತವರ ಮತ್ತು ಹೈಡ್ರೊಕ್ಲೋರಿಕ್ ಆಮ್ಲ, ಸೋಡಿಯಂ ಅಮಾಲ್ಗಂ ಮತ್ತು ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ, ಸೋಡಿಯಂ ಮತ್ತು ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ ಮುಖ್ಯವಾದುವು. ಇವುಗಳಲ್ಲದೆ ಈಚೆಗೆ ಸೋಡಿಯಂ ಹೈಡ್ರೈಡ್, ಅಲ್ಯೂಮಿನಿಯಂ ಐಸೊಪ್ರೊಪಾಕ್ಸೈಡ್, ಲಿಥಿಯಂ ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರೈಡ್ ವೇಗವರ್ಧಕದ ಸಂಪರ್ಕದಲ್ಲಿ ಹೈಡ್ರೊಜನ್ ಇತ್ಯಾದಿಗಳನ್ನು ಉಪಯೋಗಿಸುತ್ತಾರೆ.
R.CHO + 2[H] → R.CH2OH
ಆಲ್ಡಿಹೈಡ್ ಪ್ರೈಮರಿ ಆಲ್ಕೊಹಾಲ್
R.CO.R' + 2[H] → R.CH(OH).R'
ಕೀಟೋನ್ ಸೆಕೆಂಡರಿ ಆಲ್ಕೊಹಾಲ್
R.CO.OR' + 4[H] → R.CH2OH + R'OH
ಎರಡು ಆಲ್ಕೊಹಾಲ್ಗಳ ಮಿಶ್ರಣ
ಕ್ರೋಟನಾಲ್ಡಿಹೈಡ್ ಕ್ರೋಟೈಲ್ ಆಲ್ಕೊಹಾಲ್
ಅಪರ್ಯಾಪ್ತ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ತಯಾರಿಸಲು ಈ ವಿಧಾನ ಬಲು ಅನುಕೂಲ.
ಅಸಿಟೋನ್ ಐಸೊಪ್ರೊಪೈಲ್ ಆಲ್ಕೊಹಾಲ್
ಎಸ್ಟರುಗಳಿಂದ 6 ಅಥವಾ ಹೆಚ್ಚು ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳಿರುವ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ತಯಾರಿಸಲು ಈ ವಿಧಾನ ಸಹಕಾರಿ. 2000 ಸೆ0. ಗ್ರೇ ಉಷ್ಣತೆ, 150-200 ವಾಯುಭಾರ ಒತ್ತಡ ಮತ್ತು ತಾಮ್ರದ ಕ್ರೋಮೈಟ್ (CuCr2O4) ವೇಗವರ್ಧಕ ಇಷ್ಟಿದ್ದರೆ ಎಸ್ಟರು ಹೈಡ್ರೊಜನ್ನನ್ನು ಹೀರಿಕೊಂಡು ಆಲ್ಕೊಹಾಲನ್ನು ಕೊಡುವುದು. ಸಮಸಂಖ್ಯೆ ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳಿರುವ ಸರಳ ರೇಖಾವಿನ್ಯಾಸದ ಪ್ರೈಮರಿ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಉನ್ನತ ಫ್ಯಾಟಿ ಆಮ್ಲಗಳ ಅಪಕರ್ಷಣದಿಂದ ಪಡೆಯಬಹುದು.
ನಾರ್ಮಲ್ ಲಾರಿಕ್ ಆಮ್ಲ ನಾರ್ಮಲ್ ಲಾರೈಲ್ ಆಲ್ಕೊಹಾಲ್
4. ಆಲ್ಡಿಹೈಡುಗಳು, ಕೀಟೋನುಗಳು ಮತ್ತು ಎಸ್ಟರುಗಳೊಡನೆ ಗ್ರಿಗ್ನಾರ್ಡ್ ಪರಿವರ್ತಕದ ಕ್ರಿಯೆಯಿಂದ ಪ್ರೈಮರಿ, ಸೆಕೆಂಡರಿ ಮತ್ತು ಟರ್ಷಿಯರಿ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಹೀಗೆ ತಯಾರಿಸಬಹುದು.



5. ಆಮ್ಲಗಳ ಅಪಕರ್ಷಣದಿಂದ a)ಲಿಥಿಯಂ ಅಲ್ಯೂಮಿನಿಯಂ ಹೈಡ್ರೈಡು ಆಮ್ಲವನ್ನು ನೇರವಾಗಿ ಆಲ್ಕೊಹಾಲಿಗೆ ಪರಿವರ್ತಿಸಬಲ್ಲುದು.
CH3.(CH2)16.COOH → CH3.(CH2)16.CH2OH
ಸ್ಟಿಯರಿಕ್ ಆಮ್ಲ ಆಕ್ಟಡೆಕನಾಲ್ -೧
b) ಆಮ್ಲವನ್ನು ಅದರ ಕ್ಲೋರೈಡ್ ಅಥವಾ ಅನ್ಹೈಡ್ರೈಡಿಗೆ ಪರಿವರ್ತಿಸಿ ಅನಂತರ ವೇಗವರ್ಧಕದ ಸಂಪರ್ಕದಲ್ಲಿ ಅಪಕರ್ಷಿಸುವುದು.
R.CO
O R.CH2OH + R.CO.OH
R.CO
6. ಎಸ್ಟರುಗಳ ಜಲವಿಶ್ಲೇಷಣೆಯಿಂದ: ಎಸ್ಟರುಗಳನ್ನು ಆಮ್ಲ ಅಥವಾ ಕ್ಷಾರಗಳೊಡನೆ ಕುದಿಸಿದರೆ ಆಯಾ ಆಲ್ಕೊಹಾಲ್ ಬರುವುದು. ಪ್ರಕೃತಿದತ್ತ ಎಸ್ಟರುಗಳಾದ ಮೇಣ ಇತ್ಯಾದಿಗಳಿಂದ ಆಲ್ಕೊಹಾಲನ್ನು ತಯಾರಿಸಲು ಈ ಕ್ರಮವನ್ನು ಅನುಸರಿಸಬಹುದು.
ಮಿರಿಸಿಲ್ ಪಾಮಿಟೇಟ್ ಪಾಮಿಟಿಕ್ ಆಮ್ಲ ಮಿರಿಸಿಲ್ ಆಲ್ಕೊಹಾಲ್
(ಜೇನುಮೇಣ)
7. ಫರ್ಮೆಂಟೇಷನ್ ವಿಧಾನ: ಸರಳ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಕೈಗಾರಿಕಾ ಪ್ರಮಾಣದಲ್ಲಿ ತಯಾರಿಸುವುದು ಹೀಗೆಯೇ. ಇದರ ಬಗ್ಗೆ ವಿವರಗಳನ್ನು ಮುಂದೆ ಪ್ರಸ್ತಾಪಿಸಲಾಗಿದೆ.
ಸಾಮಾನ್ಯ ಗುಣಗಳು
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೊಹಾಲ್ಗಳು ನಿರ್ವರ್ಣವಾದ ತಟಸ್ಥ ವಸ್ತುಗಳು. ಅಣುತೂಕ ಕಡಿಮೆಯಿರುವ ಆಲ್ಕೊಹಾಲ್ಗಳು ದ್ರವಗಳು. ಅಣುತೂಕ ಹೆಚ್ಚಿದಂತೆ ಎಣ್ಣೆಯಂತೆ ಮಂದವಾಗುವುವು. 12 ಅಥವಾ ಹೆಚ್ಚು ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳಿರುವ ಆಲ್ಕೊಹಾಲ್ಗಳು ಮೇಣದಂತಿರುವ ಘನಗಳು. 5 ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳವರೆಗೆ ಹೊಂದಿರುವ ಆಲ್ಕೊಹಾಲ್ಗಳು ನೀರಿನಲ್ಲಿ ದ್ರಾವ್ಯ. ಅಣುತೂಕ ಹೆಚ್ಚಿದಂತೆ ದ್ರಾವಣತೆಯೂ ಕಡಿಮೆಯಾಗುವುದು. 16ಕ್ಕೂ ಮೀರಿ ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳಿರುವ ಆಲ್ಕೊಹಾಲ್ಗಳು ಅದ್ರಾವ್ಯ ವಸ್ತುಗಳು. ಒಂದೇ ವರ್ಗದ ಆಲ್ಕೊಹಾಲ್ಗಳ ಕುದಿಯುವ ಬಿಂದು ಕ್ರಮವಾಗಿ ಅಂದರೆ ಪ್ರತಿಯೊಂದು - CH2 ಗ್ರೂಪ್ ಸೇರ್ಪಡೆಗೆ ಸುಮಾರು 200 ಸೆಂ. ಗ್ರೇಡಿನಷ್ಟು ಹೆಚ್ಚುತ್ತ ಹೋಗುವುದು. ಸಮಾನ ಅಣುತೂಕಗಳುಳ್ಳ ಆಲ್ಕೈಲ್ ಹ್ಯಾಲೈಡುಗಳು ಅಥವಾ ಈಥರ್ಗಳಿಗಿಂತ ಆಲ್ಕೊಹಾಲ್ಗಳ ಕುದಿಯುವ ಬಿಂದು ಹೆಚ್ಚಾಗಿರುತ್ತದೆ. ಇದಕ್ಕೆ ಕಾರಣವಿದೆ. ನೀರಿನ ಅಣುಗಳು ಹೈಡ್ರೊಜನ್ ಬಂಧದ ಮೂಲಕ ಸಂಘಟಿಸುವಂತೆ ಆಲ್ಕೊಹಾಲಿನ ಅಣುಗಳೂ ಒಟ್ಟುಗೂಡಿ ದೊಡ್ಡ ಅಣುಗಳು ಜನಿಸುತ್ತವೆ. ಇಂಥ ದೊಡ್ಡ ಅಣುಗಳಿಗೆ ಅವ್ಯಾಸಕ್ತಿ ಕಡಿಮೆಯಾಗಿರುವುದು ಸಹಜ. ಅಣುತೂಕ ಹೋಲಿಕೆಯುಳ್ಳ ಮೀಥೇನ್ (16) ಮತ್ತು ಅಮೊನಿಯಾ (17) ಗಳಿಗಿಂತ, ನೀರಿನ (18) ಕುದಿಯುವ ಬಿಂದು ಹೆಚ್ಚಾಗಿರುವುದೇ ಇದಕ್ಕೆ ಸಾಕ್ಷಿ. ಹೈಡ್ರೊಜನ್ನಿನ ಬಂಧದ ಮೂಲಕ ದೊಡ್ಡ ಅಣುಗಳ ಜನನವಾಗುತ್ತದೆ.
ಆಲ್ಕೊಹಾಲ್ಗಳಿಗೆ ವಿಶಿಷ್ಟ ರುಚಿ ವಾಸನೆಗಳುಂಟು. C4-C7 ಆಲ್ಕೊಹಾಲ್ಗಳ ವಾಸನೆ ಹಿತಕರವಲ್ಲ. C8-C12 ಆಲ್ಕೊಹಾಲ್ಗಳು ಮಧುರವಾಸನೆಯುಳ್ಳವು. ಈ ಮಿತಿ ಮೀರಿದರೆ ವಾಸನೆ ಮತ್ತು ರುಚಿರಹಿತವಾಗುವುವು.
ಆಲ್ಕೊಹಾಲ್ಗಳು ಪೋಲಾರ್ ವಸ್ತುಗಳಂತೆ ವರ್ತಿಸುತ್ತವೆ. ಕೆಲವು ಪರಿವರ್ತಕಗಳೊಡನೆ ಅವು ನೀರಿನಂತೆ ನಡೆದುಕೊಳ್ಳುತ್ತವೆ. ನೀರಿನಲ್ಲಿ ಲೀನವಾಗುವ ಅನೇಕ ನಿರವಯವ ವಸ್ತುಗಳು ಆಲ್ಕೊಹಾಲಿನಲ್ಲಿಯೂ ಲೀನವಾಗುವುವು. ಕೆಲವು ಕ್ರಿಯೆಗಳಲ್ಲಿ ಆಮ್ಲೀಯ ಸ್ವಭಾವವನ್ನೂ ಇತರ ಸಂದರ್ಭಗಳಲ್ಲಿ ಪ್ರತ್ಯಾಮ್ಲೀಯ ಗುಣವನ್ನೂ ಪ್ರದರ್ಶಿಸುವುದು ಇವುಗಳ ವೈಶಿಷ್ಟ್ಯ. ಕಾರ್ಬಿನಾಲ್ ಗುಂಪು
| | -C-OH , -C-......H ರೀತಿ ವಿಭಜಿಸಿದರೆ ಆಮ್ಲದಂತೆಯೂ | | | -C-......OH ರೀತಿ ವಿಭಾಗವಾದರೆ ಪ್ರತ್ಯಾಮ್ಲದಂತೆಯೂ ವರ್ತಿಸುತ್ತದೆ. |
ಹೀಗಾಗಲು ಆಲ್ಕೈಲ್ ಗ್ರೂಪುಗಳಿಗೆ ಎಲೆಕ್ಟ್ರಾನುಗಳನ್ನು ವಿಸರ್ಜಿಸುವ ಪ್ರವೃತ್ತಿ ಹೆಚ್ಚಾಗಿರುವುದು ಕಾರಣ. ಕಾರ್ಬಿನಾಲ್ ಕಾರ್ಬನ್ನಿನ ಸುತ್ತ ಅವುಗಳ ಸಂಖ್ಯೆ ಹೆಚ್ಚಿದಂತೆಲ್ಲ ಅದರ ಎಲೆಕ್ಟ್ರಾನ್ ಸಾಂದ್ರತೆ ವೃದ್ಧಿಯಾಗುವುದು. ಪರಿಣಾಮವಾಗಿ ಅದರ ಒಂದಂಶ ಆಕ್ಸಿಜನ್ ಪರಮಾಣುವಿಗೆ ವರ್ಗಾವಣೆಯಾಗುವುದು. ಇದರಿಂದ ಆಕ್ಸಿಜನ್ ಹೈಡ್ರೊಜನ್ನಿನ ಪರಮಾಣುವಿಗೆ ಬಲವಾಗಿ ಅಂಟಿಕೊಳ್ಳುವುದು. ಆದ್ದರಿಂದಲೇ ಪ್ರೈಮರಿ ಆಲ್ಕೊಹಾಲ್ಗಳಿಗಿಂತ ಟರ್ಷಿಯರಿ ಅಲ್ಕೊಹಾಲ್ಗಳಿಗೆ ಪ್ರತ್ಯಾಮ್ಲೀಯ ಸ್ವಭಾವ ಹೆಚ್ಚು ಮತ್ತು ಅವುಗಳಲ್ಲಿರುವ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪುಗಳನ್ನು ಹ್ಯಾಲೋಜನ್ ಪರಮಾಣುಗಳಿಂದ ಪಲ್ಲಟಿಸಬಹುದು. ಪ್ರೈಮರಿ ಆಲ್ಕೊಹಾಲ್ಗಳಲ್ಲಿ ಕಾರ್ಬಿನಾಲ್ ಕಾರ್ಬನ್ ಮೇಲೆ ಮೀಥೈಲ್ ಗುಂಪಿನ ಪ್ರೇರಕ ಪ್ರಭಾವ (ಇಂಡಕ್ಟಿವ್ ಇಫೆಕ್ಟ್ ) ಕಡಿಮೆ. ಆದ್ದರಿಂದ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪಿನ ಆಕ್ಸಿಜನ್ ಪರಮಾಣು ಹೈಡ್ರೊಜನ್ ಮತ್ತು ಮೀಥೈಲ್ ಗುಂಪಿನಿಂದ ಎಲೆಕ್ಟ್ರಾನ್ ಜೋಡಿಗಳನ್ನು ತನ್ನೆಡೆಗೆ ಸೆಳೆದುಕೊಳ್ಳಲು ಹವಣಿಸುತ್ತದೆ. ತತ್ಫಲವಾಗಿ ಹೈಡ್ರೊಜನ್ ಪರಮಾಣು ಆಯಾನ್ ರೂಪದಲ್ಲಿ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ. ಅಂದರೆ ಆಮ್ಲದಂತೆ ವರ್ತಿಸುತ್ತದೆ.
ಆಲ್ಕೊಹಾಲ್ಗಳ ಆಮ್ಲೀಯ ಗುಣ
[ಬದಲಾಯಿಸಿ]ಕೆಳಕಂಡ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳು ಇದನ್ನು ಸಮರ್ಥಿಸುತ್ತದೆ.
೧. ಕ್ರಿಯಾಶಾಲಿ ಲೋಹಗಳೊಡನೆ ವರ್ತನೆ: ಸೋಡಿಯಂ ಲೋಹದೊಡನೆ ವರ್ತಿಸಿದಾಗ ಹೈಡ್ರೊಜನ್ ಬಿಡುಗಡೆಯಾಗುವುದು.
2ROH + 2Na → 2RONa + H2↑
ಸೋಡಿಯಂ
ಆಲ್ಕಾಕ್ಸೈಡ್
ಆಲ್ಕೊಹಾಲ್ಗಳು ನೀರಿಗಿಂತ ದುರ್ಬಲ ಆಮ್ಲಗಳು. ಆದ್ದರಿಂದ ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡಿನ ವರ್ತನೆಯಿಂದ ಆಲ್ಕಾಕ್ಸೈಡುಗಳನ್ನು ಪಡೆಯುವಂತಿಲ್ಲ. ಅದಕ್ಕೆ ಆಯಾ ಪಟುಲೋಹವೇ ಅಗತ್ಯ. ಐಸೊಪ್ರೊಪೈಲ್ ಮತ್ತು ಟರ್ಷಿಯರಿ ಬ್ಯೂಟೈಲ್ ಆಲ್ಕೊಹಾಲ್ಗಳೊಡನೆ ಅಲ್ಯೂಮಿನಿಯಂ ಅಮಾಲ್ಗಂ ವರ್ತನೆಯಿಂದ ಆಯಾ ಆಲ್ಕಾಕ್ಸೈಡುಗಳು ಉಂಟಾಗುವುವು.
೨. ಗ್ರಿನ್ಯಾರ್ಡ್ ಪರಿವರ್ತಕದೊಡನೆ ವರ್ತಿಸಿದಾಗ ಒಂದೊಂದು ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗ್ರೂಪಿಗೂ ಪ್ರತಿಯಾಗಿ ಆಲ್ಕೇನಿನ ಒಂದು ಅಣು ಉತ್ಪತ್ತಿಯಾಗುವುದು. ಉಪಯೋಗಿಸಿದ ಗ್ರಿನ್ಯಾರ್ಡ್ ಪರಿವರ್ತಕ ಮೀಥೈಲ್ ಮೆಗ್ನೀಸಿಯಂ ಅಯೊಡೈಡ್ ಆಗಿದ್ದರೆ ಮೀಥೇನ್ ಬಿಡುಗಡೆಯಾಗುವುದು.
ROH + CH3MgI → CH4 ↑ + ROMgI
ಬಿಡುಗಡೆಯಾದ ಮೀಥೇನ್ ಅನಿಲದ ಗಾತ್ರವನ್ನು ಅಳೆದು ಆಲ್ಕೊಹಾಲ್ (ಅಥವಾ ಯಾವುದಾದರೂ ಸಾವಯವ ಸಂಯುಕ್ತ) ಅಣುವಿನಲ್ಲಿರುವ ಕ್ರಿಯಾಶಾಲಿ ಹೈಡ್ರೊಜನ್ನ (ಆಕ್ಟಿವ್ ಹೈಡ್ರೊಜನ್) ಅಂಶವನ್ನು ನಿರ್ಣಯಿಸಬಹುದು. ಇದಕ್ಕೆ ಜೆ಼ರೆವಿಟಿನೋಫ್ ವಿಧಾನ ಎಂದು ಹೆಸರು.
R.O R' R.O.R' + NaI
೩. ಈಥರ್ಗಳ ಉತ್ಪನ್ನ: (a) ಸೋಡಿಯಂ ಆಲ್ಕಾಕ್ಸೈಡ್ ಮತ್ತು ಆಲ್ಕೈಲ್ ಹ್ಯಾಲೈಡುಗಳ ಪರಸ್ಪರ ವರ್ತನೆಯಿಂದ ಈಥರ್ಗಳು ಉಂಟಾಗುವುವು.
(b) ನಿಯಂತ್ರಿತ ಪ್ರಯೋಗಸ್ಥಿತಿಯಲ್ಲಿ, ಆಲ್ಕೊಹಾಲನ್ನು ನಿರ್ಜಲಗೊಳಿಸಿ ಈಥರ್ಗಳನ್ನು ಪಡೆಯಲು ಸಾಧ್ಯ. ಉದಾಹರಣೆಗೆ ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲನ್ನು ಪ್ರಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದೊಂದಿಗೆ 1400 - 1450 ಸೆಂ.ಗ್ರೇ. ಕಾಸಿದಾಗ ಡೈಈಥೈಲ್ ಈಥರ್ ದೊರೆಯುವುದು.
C2H5O + SO2.OH → C2H5O.SO2.OH + H2O
C2H5O.SO2.OH + C2H5OH → C2H5.O.C2H5 + H2SO4
ಉಷ್ಣತೆ 1700 ಸೆಂ.ಗ್ರೇ. ಮುಟ್ಟಿದರೆ ಎಥಿಲೀನ್ ಉಂಟಾಗುವುದು.
೪. ಅಸಿಟಲೇಷನ್: ಆಮ್ಲೀಯ ಕ್ಲೋರೈಡುಗಳು ಅಥವಾ ಆನ್ಹೈಡ್ರೈಡುಗಳು ಆಲ್ಕೊಹಾಲ್ಗಳೊಡನೆ ವರ್ತಿಸುವುವು. ಪಿರಡೀನಿನ ಸಂಪರ್ಕದಲ್ಲೆ ಅಸಿಟೈಲ್ ಕ್ಲೋರೈಡ್ ಅಥವಾ ಅಸಿಟೆಕ್ ಆನ್ಹೈಡ್ರೈಡುಗಳು ಭಾಗವಹಿಸಿದರೆ ಕ್ರಿಯೆಗೆ ಅಸಿಟಿಲೇಷನ್ ಎನ್ನುವರು. ಇದು ಆಲ್ಕೊಹಾಲನ್ನು ಗುರುತಿಸುವ ಒಂದು ಪರೀಕ್ಷಾ ಪ್ರಯೋಗವಾಗಿದೆ.
ROH + Cl.OC.R → ROOC.R + HCl
ಎಸ್ಟರ್
OC.R'
ROH + O → ROOC.R' + R'.COOH
OC.R'
೫. ಎಸ್ಟರಿಫಿಕೇಷನ್: ಕ್ಷಾರ ಆಮ್ಲದೊಡನೆ ವರ್ತಿಸಿ ಲವಣ ಮತ್ತು ನೀರನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವುದು. ಈ ಕ್ರಿಯೆಗೆ ತಟಸ್ಥೀಕರಣ ಎನ್ನತ್ತೇವೆ. ಹಾಗೆಯೇ ಆಲ್ಕೊಹಾಲ್ ಸಾವಯವ ಅಥವಾ ನಿರವಯವ ಆಮ್ಲಗಳೊಡನೆ ವರ್ತಿಸಿದಾಗ ಲವಣ ಸದೃಶವಾದ ಎಸ್ಟರುಗಳು ಮತ್ತು ನೀರು ಉಂಟಾಗುತ್ತವೆ. ಆದ್ದರಿಂದ ಇದಕ್ಕೆ ಎಸ್ಟರಿಫಿಕೇಷನ್ ಎಂದು ಹೆಸರಾಗಿದೆ.
ROH + HO.OC.R' R.O.OC.R' + H2O
ಆಲ್ಕೊಹಾಲ್ ಆಮ್ಲ ಎಸ್ಟರ್ ನೀರು
ಇದೊಂದು ಹಿಮ್ಮರಳುವ ಕ್ರಿಯೆ. ಆದ್ದರಿಂದ ಉತ್ಪತ್ತಿಯಾದ ನೀರನ್ನು ಅವಶೋಷಿಸಿದ ಹೊರತು ಕ್ರಿಯೆ ಪೂರ್ಣವಾಗುವುದಿಲ್ಲ. ಇದಕ್ಕೆ ನಿರ್ಜಲಕಾರಿಯಾಗಿ ಪ್ರಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲವನ್ನಾಗಲೀ ಅಥವಾ ಶುಷ್ಕ ಹೈಡ್ರೊಜನ್ ಕ್ಲೋರೈಡನ್ನಾಗಲೀ ಉಪಯೋಗಿಸುವುದು ವಾಡಿಕೆ. 18 ತೂಕಮಾನದ ಆಕ್ಸಿಜನ್ ಸಮಸ್ಥಾನಿಯನ್ನು ಬಳಸಿ ಆಲ್ಕೊಹಾಲ್ ಹೈಡ್ರೊಜನ್ನನ್ನೂ ಆಮ್ಲ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗ್ರೂಪನ್ನೂ ಒದಗಿಸುವುದೆಂದು ಖಚಿತವಾಗಿ ತೋರಿಸಲಾಗಿದೆ. ಇಲ್ಲದಿದ್ದರೆ ನೀರಿನ ಅಣು 018 ಸಮಸ್ಥಾನಿಯನ್ನು ಹೊಂದಿರಬೇಕಾಗುತ್ತಿತ್ತು.
ಆಲ್ಕೊಹಾಲ್ಗಳ ಪ್ರತ್ಯಾಮ್ಲೀಯ ಸ್ವಭಾವ
[ಬದಲಾಯಿಸಿ]ಮುಂದೆ ವಿವರಿಸಿರುವ ಕ್ರಿಯೆಗಳಿಂದ ಇದು ವೇದ್ಯವಾಗುತ್ತದೆ.
೧. ಆಲ್ಕೈಲ್ ಹ್ಯಾಲೈಡುಗಳ ಉತ್ಪನ್ನ: ಹ್ಯಾಲೊಜನ್ ಆಮ್ಲಗಳೊಡನೆ ಆಲ್ಕೊಹಾಲ್ಗಳು ವರ್ತಿಸಿದಾಗ ಇವು ಉಂಟಾಗುವುವು.
ಇಲ್ಲಿನ ನೀರಿನ ಅಣು ಉತ್ಪತ್ತಿಯಾಗಲು ಆಲ್ಕೊಹಾಲ್ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪನ್ನು ಒದಗಿಸಿದೆ ಎಂಬುದನ್ನು ಗಮನಿಸಬೇಕು. ಟರ್ಷಿಯರಿ ಆಲ್ಕೊಹಾಲ್ಗಳು ಈ ಕ್ರಿಯೆಯಲ್ಲಿ ಸುಲಭವಾಗಿ ಭಾಗವಹಿಸುತ್ತವೆ.
೨. ಫಾಸ್ಫರಸ್ ಹ್ಯಾಲೈಡುಗಳೊಡನೆ ವರ್ತನೆ: ಉದಾಹರಣೆ ಫಾಸ್ಫರಸ್ ಪೆಂಟಕ್ಲೋರೈಡು ಆಲ್ಕೋಹಾಲಿನಲ್ಲಿರುವ ಹೈಡ್ರಾಕ್ಸಿಲ್ ಗುಂಪನ್ನು ಕ್ಲೋರಿನ್ ಪರಮಾಣುವಿನಿಂದ ಪಲ್ಲಟಿಸಿ ಆಯಾ ಆಲ್ಕೈಲ್ ಕ್ಲೋರೈಡನ್ನು ಕೊಡುವುದು.
R.OH + PCl5 → R.Cl + POCl3 + HCl
ಫಾಸ್ಫರಸ್ ಟ್ರೈಕ್ಲೋರೈಡನ್ನು ಉಪಯೋಗಿಸಿದಾಗ ಫಾಸ್ಫರಸ್ ಆಮ್ಲ ಬರುವುದು.
3R.OH + PCl3 → 3RCl + H3PO3
ಮೊದಲನೆಯ ಕ್ರಿಯೆಯಲ್ಲಿ ಹೈಡ್ರೊಜನ್ ಕ್ಲೋರೈಡ್ ಹೊರಬೀಳುವುದರಿಂದ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಹೀಗೂ ಗುರುತಿಸಬಹುದು. ಆದರೆ ನೀರಿನೊಡನೆ ಫಾಸ್ಫರಸ್ ಪೆಂಟಕ್ಲೋರೈಡ್ ವರ್ತಿಸಿದಾಗಲೂ ಹೈಡ್ರೊಜನ್ ಕ್ಲೋರೈಡ್ ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ ಆಲ್ಕೊಹಾಲ್ ಜಲರಹಿತವಾಗಿದ್ದರೆ ಮಾತ್ರ ಈ ಪರೀಕ್ಷಾ ಪ್ರಯೋಗದ ಫಲಿತಾಂಶವನ್ನು ನೆಚ್ಚಬಹುದು.
ನಿರ್ಜಲೀಕರಣ
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೊಹಾಲ್ಗಳಲ್ಲಿರುವ ಅಕ್ಕಪಕ್ಕದ ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳಿಂದ ನೀರಿನ ಅಂಗಮೂಲವಸ್ತುಗಳಾದ ಹೈಡ್ರೊಜನ್ ಮತ್ತು ಆಕ್ಸಿಜನ್ ತೆಗೆಯುವುದರಿಂದ ಅಪರ್ಯಾಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ಗಳು ಲಭಿಸುತ್ತವೆ. ಇದಕ್ಕೆ ಅಗತ್ಯವಾದ ನಿರ್ಜಲಕಾರಿಗಳು ಮತ್ತು ಪ್ರಯೋಗಸ್ಥಿತಿಗಳಿವೆ. ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲಗಳಂತಹ ಪ್ರಬಲ ಆಮ್ಲಗಳು ವೇಗವರ್ಧಕಗಳಾಗುತ್ತವೆ. ಪ್ರೈಮರಿ ಆಲ್ಕೊಹಾಲ್ಗಳಿಗೆ ಹೆಚ್ಚಿನ ಉಷ್ಣಾಂಶ ಬೇಕು. ಟರ್ಷಿಯರಿ ಆಲ್ಕೊಹಾಲ್ಗಳಿಗೆ ಅಷ್ಟು ಹೆಚ್ಚು ಉಷ್ಣಾಂಶ ಬೇಕಿಲ್ಲ.

ಇಲ್ಲೂ ಸಹ ಟರ್ಷಿಯರಿ ಆಲ್ಕೊಹಾಲ್ಗಳು ಅತಿ ಸುಲಭವಾಗಿ ನಿರ್ಜಲಗೊಳ್ಳುವುವು.
ಉತ್ಕರ್ಷಣ
[ಬದಲಾಯಿಸಿ]ಪ್ರೈಮರಿ ಆಲ್ಕೊಹಾಲ್ಗಳು ಮೊದಲು ಆಲ್ಡಿಹೈಡುಗಳಾಗಿ ಅನಂತರ ಆಮ್ಲಗಳಿಗೆ ಉತ್ಕರ್ಷಿತವಾಗುವುವು. ಸೆಕೆಂಡರಿ ಆಲ್ಕೊಹಾಲ್ಗಳು ಕೀಟೋನುಗಳಾಗುವುವು.
ಟರ್ಷಿಯರಿ ಆಲ್ಕೊಹಾಲ್ಗಳ ಮೇಲೆ ಏನೂ ಪರಿಣಾಮವಾಗುವುದಿಲ್ಲ. ಪ್ರಯೋಗ ಸ್ಥಿತಿ ತೀವ್ರವಾಗಿದ್ದರೆ ಆಲ್ಕೊಹಾಲಿನ ಅಣು ಛಿದ್ರವಾಗಿ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ನೀರು ಇತ್ಯಾದಿಗಳು ಉಂಟಾಗುತ್ತವೆ. ಇದರ ಸಲುವಾಗಿ ಬಳಸುವ ಉತ್ಕರ್ಷಣಕಾರಿಗಳೆಂದರೆ ಪೊಟ್ಯಾಸಿಯಂ ಪರ್ಮ್ಯಾಂಗನೇಟ್, ಆಮ್ಲಮಿಶ್ರಿತ ಮ್ಯಾಂಗನೀಸ್ ಡೈಆಕ್ಸೈಡ್ ಅಥವಾ ಪೊಟ್ಯಾಸಿಯಂ ಡೈಕ್ರೊಮೇಟುಗಳು. ಆದರೆ ಆಲ್ಕೊಹಾಲಿನ ಆವಿಯನ್ನು ೨೫೦೦ - ೩೦೦೦ ಸೆಂ.ಗ್ರೇಡಿಗೆ ಕಾಸಿದಾಗ ತಾಮ್ರದ ಪುಡಿಯ ಮೇಲೆ ಹಾಯಿಸಿದರೆ ಇನ್ನೊಂದು ರೀತಿಯ ಉತ್ಕರ್ಷಣ ನಡೆಯುವುದು.
ಪ್ರೈಮರಿ, ಸೆಕೆಂಡರಿ ಮತ್ತು ಟರ್ಷಿಯರಿ ಆಲ್ಕೋಹಾಲ್ಗಳನ್ನು ಪರಸ್ಪರ ಗುರುತಿಸಲು ಈ ಕ್ರಿಯೆ ನೆರವಾಗುತ್ತದೆ.
ಅಪಕರ್ಷಣ
[ಬದಲಾಯಿಸಿ]ಹೆಚ್ಚುವರಿ ಹೈಡ್ರಯೊಡಿಕಾಮ್ಲ ಆಲ್ಕೊಹಾಲನ್ನು ನೇರವಾಗಿ ಅಪಕರ್ಷಿಸುತ್ತದೆ.
R I R I + H2O R H R H + I2
ಹ್ಯಾಲೊಫಾರಂ ಕ್ರಿಯೆ
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೊಹಾಲ್ ಆದರೂ ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ಮತ್ತು ಅಯೊಡೀನಿನೊಡನೆ ಕಾಯಿಸಿದಾಗ ಅಯೊಡೋಫಾರಂ (CHI3) ಹಳದಿ ಒತ್ತರವಾಗಿ ಬೇರ್ಪಡುವುದು. ಇದಕ್ಕೆ ವಿಶಿಷ್ಟವಾಸನೆಯುಂಟು. ಈ ಕ್ರಿಯೆ ಮೂರು ಹಂತಗಳಲ್ಲಿ ನಡೆಯುತ್ತದೆ.
H | R-C-OH | ಉತ್ಕರ್ಷಣ ಕೀಟೋನ್ CH3 3I2 + 3NaOH ಹ್ಯಾಲೊಜನೇಷನ್ ಅಯೊಡೊಫಾರಂ ವಿಭಜನೆ
ಕ್ಲೋರಿನ್ ಅಥವಾ ಬ್ರೋಮಿನ್ ಉಪಯೋಗಿಸಿದರೆ ಕ್ರಮವಾಗಿ ಕ್ಲೋರೋಫಾರಂ (CHCl3) ಮತ್ತು ಬ್ರೋಮೋಫಾರಂ (CHBr3) ಬರುವುದರಿಂದ ಇದಕ್ಕೆ ಹ್ಯಾಲೊಫಾರಂ ಕ್ರಿಯೆ ಎಂದು ಹೆಸರಾಗಿದೆ.
ಆಲ್ಕೊಹಾಲ್ ಎಂದು ಹೆಸರಿರುವ ವಸ್ತುಗಳೆಲ್ಲ ಮೇಲೆ ವಿವರಿಸಿದ ರಾಸಾಯನಿಕ ಲಕ್ಷಣಗಳನ್ನು ಪಡೆದಿವೆ.
ಆಲ್ಕೊಹಾಲ್ಗಳ ಉದಾಹರಣೆಗಳು
[ಬದಲಾಯಿಸಿ]ಮೀಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ (ಮಿಥೆನಾಲ್ ಅಥವಾ ವುಡ್ ಸ್ಪಿರಿಟ್)
[ಬದಲಾಯಿಸಿ]ಮೀಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ ಎಂದರೆ ಮರದಿಂದ ಮದ್ಯ ಎಂದು ಅರ್ಥ. ಮರದ ಚೂರುಗಳನ್ನು ವಿನಾಶಕ ಬಾಷ್ಪಸಾಂದ್ರೀಕರಣಕ್ಕೆ ಒಳಪಡಿಸಿ ಇದನ್ನು ತಯಾರಿಸುತ್ತಿದ್ದರು. ಆದ್ದರಿಂದ ಈ ಹೆಸರು ಬಂದಿದೆ. (CH3OH) ಎಂಬ ಅಣುಸೂತ್ರವನ್ನೂ 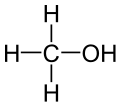 ರಚನೆಯನ್ನೂ ಹೊಂದಿರುವ ಈ ಆಲ್ಕೊಹಾಲ್ ವಿಷವಸ್ತು.
ರಚನೆಯನ್ನೂ ಹೊಂದಿರುವ ಈ ಆಲ್ಕೊಹಾಲ್ ವಿಷವಸ್ತು.
ಕೈಗಾರಿಕಾ ತಯಾರಿಕೆ: (a) ಮರದಿಂದ: ಒಣಗಿಸಿದ ಗಟ್ಟಿ ಸೌದೆಯನ್ನು ಕಬ್ಬಿಣದ ರಿಟಾರ್ಟುಗಳಲ್ಲಿಟ್ಟು ಗಾಳಿಯ ಸಂಪರ್ಕವಿಲ್ಲದಂತೆ ೪೫೦೦ - ೫೬೦೦ ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿ ಸುಮಾರು ೩೦ ಗಂಟೆಗಳ ಕಾಲ ಕಾಸಿದರೆ ಕೆಳಕಂಡ ವಸ್ತುಗಳು ದೊರೆಯುತ್ತವೆ.
೧. ವುಡ್ಗ್ಯಾಸ್ (ಕಾಷ್ಠಾನಿಲ) - ದಹ್ಯಾನಿಲಗಳ ಮಿಶ್ರಣವಿದು. ಇದರಲ್ಲಿ ಮುಖ್ಯವಾಗಿ ಮೀಥೇನ್ ಮತ್ತು ಕಾರ್ಬನ್ ಮಾನಾಕ್ಸೈಡ್ ಇರುತ್ತವೆ.
೨. ಪೈರೊಲಿಗ್ನಿಯಸ್ ಆಮ್ಲ - ಜಲಯುಕ್ತ ದ್ರವಭಾಗ. ಇದರಲ್ಲಿ ಅಸಿಟಿಕ್ ಆಮ್ಲ (೯-೧೦%), ಮಿಥೆನಾಲ್ (೧-೨% ) ಮತ್ತು ಅಸಿಟೋನ್ (೦.೧-೦.೫%) ಮುಖ್ಯವಾಗಿರುತ್ತವೆ.
೩. ಡಾಂಬರು ಮತ್ತು ಇದ್ದಿಲು ಇತರ ಉಪವಸ್ತುಗಳು.
ಪೈರೊಲಿಗ್ನಿಯಸ್ ಆಮ್ಲದ ಸಂಸ್ಕರಣ: ಡಾಂಬರಿನ ಮೇಲೆ ನಿಲ್ಲುವ ಕಂದು ಬಣ್ಣದ ದ್ರವವಸ್ತುವೇ ಪೈರೊಲಿಗ್ನಿಯಸ್ ಆಮ್ಲ. ಇದನ್ನು ಬೇರ್ಪಡಿಸಿ ತಾಮ್ರದ ಪಾತ್ರೆಗಳಲ್ಲಿ ಕಾಸಲಾಗುವುದು. ಆವಿಯನ್ನು ಬಿಸಿಯಾದ ಸುಣ್ಣದ ಹಾಲಿನ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಅಸಿಟೆಕ್ ಆಮ್ಲ ಮಾತ್ರ ಹೀರಲ್ಪಟ್ಟು ಕ್ಯಾಲ್ಸಿಯಂ ಅಸಿಟೇಟಾಗಿ ಉಳಿದು ಬಿಡುವುದು. ಅಸಿಟೋನ್ (ಕು.ಬಿಂ. ೫೬೦ ಸೆಂ.ಗ್ರೇ.) ಮತ್ತು ಮಿಥೆನಾಲ್ಗಳು (ಕು.ಬಿಂ.೬೪.೫೦ ಸೆಂ.ಗ್ರೇ.) ಸ್ವಲ್ಪ ನೀರಾವಿಯೊಂದಿಗೆ ಹಾದು ಹೋಗಿ ಸಾಂದ್ರಕಗಳಲ್ಲಿ ದ್ರವರೂಪ ತಳೆಯುವುವು. ಸುಟ್ಟಸುಣ್ಣದ ಸಂಪರ್ಕದಲ್ಲಿ ಈ ದ್ರವಮಿಶ್ರಣವನ್ನು ಕುದಿಸಿದರೆ ಸುಮಾರು ೭೦% ಮಿಥೆನಾಲ್ ದೊರೆಯುವುದು. ಇದು ಮಾರುಕಟ್ಟೆಯ ವಸ್ತು. ೯೮% ಶುದ್ಧ ಮಿಥೆನಾಲ್ ಬೇಕಾದರೆ ಸೂಕ್ತ ಆಂಶಿಕ ಬಾಷ್ಪಸಾಂದ್ರಕಗಳಲ್ಲಿ ಕುದಿಸಬೇಕಾಗುತ್ತದೆ. ಇಂಥ ಆಲ್ಕೊಹಾಲಿನಲ್ಲಿ ೧-೨% ಅಸಿಟೋನ್ ಇರುವುದು. ಅಯೊಡೊಫಾರಂ ಪರೀಕ್ಷೆಯಿಂದ ಇದು ಗೊತ್ತಾಗುತ್ತದೆ. ಅಸಿಟೋನ್ ನಿವಾರಣೆಗೆ ಅನುಸರಿಸುವ ಕ್ರಮಗಳನ್ನು ಕೆಳಗೆ ಕೊಡಲಾಗಿದೆ.
೧. ಬಿಸಿಯಾದ ಆಲ್ಕೊಹಾಲಿಗೆ ಶುಷ್ಕ ಕ್ಲೋರಿನನ್ನು ಹಾಯಿಸಿದರೆ, ಟ್ರೈಕ್ಲೋರ ಸಿಟೋನ್ (CCl3.CO.CH3) ಉತ್ಪತ್ತಿಯಾಗುವುದು. ಇದರ ಕುದಿಯುವ ಬಿಂದು ಮಿಥೆನಾಲಿಗಿಂತ ಹೆಚ್ಚು. ಆದ್ದರಿಂದ ಅಂಶಿಕ ಬಾಷ್ಟೀಕರಣ ವಿಧಾನದಿಂದ ಸುಲಭವಾಗಿ ಪ್ರತ್ಯೇಕಿಸಬಹುದು.
೨. ನಿರ್ಜಲ ಕ್ಯಾಲ್ಸಿಯಂ ಕ್ಲೊರೈಡಿನೊಂದಿಗೆ ಕುಲುಕಿದರೆ ಆಲ್ಕೊಹಾಲ್ (CaCl2.4CH3OH) ಎಂಬ ಹರಳುರೂಪದ ವಸ್ತುವಾಗುವುದು. ಇದಕ್ಕೆ ಅಂಟಿರುವ ದ್ರವಭಾಗವನ್ನು ಹಿಸುಕಿ ತೆಗೆದು ಕಾಸಿದರೆ ಶುದ್ಧ ಆಲ್ಕೊಹಾಲ್ ಆವಿಯಾಗುವುದು. ಇದನ್ನು ಸಾಂದ್ರೀಕರಿಸುವರು.
೩. ಆಕ್ಸಾಲಿಕ್ ಆಮ್ಲದೊಡನೆ ವರ್ತಿಸುವಂತೆ ಮಾಡಿದರೆ ಮೀಥೈಲ್ ಆಕ್ಸ್ಲೇಟ್ ಎಂಬ ಘನರೂಪದ ಎಸ್ಟರು ಬರುತ್ತದೆ. ಅದನ್ನು ನೀರಿನಿಂದ ತೊಳೆದರೆ ಅದಕ್ಕೆ ಅಂಟಿರುವ ಅಸಿಟೋನ್ ಪರಿಹಾರವಾಗುತ್ತದೆ. ಅನಂತರ ಪೊಟ್ಯಾಷ್ ದ್ರಾವಣದೊಡನೆ ಕುದಿಸಬೇಕು. ಆಗ ಮಿಥೆನಾಲ್ ಸ್ವಲ್ಪ ನೀರಿನೊಂದಿಗೆ ಆವಿಯಾಗುವುದು. ಸುಟ್ಟ ಸುಣ್ಣದೊಡನೆ ಕುಲುಕಿ ಪುನಃ ಕುದಿಸಿದರೆ ಪರಿಶುದ್ಧ ಆಲ್ಕೊಹಾಲ್ ಲಭಿಸುವುದು. ಭದ್ರಾವತಿಯಲ್ಲಿ ಮರದಿಂದ ಮಿಥೆನಾಲ್ ಮಾಡುವ ಕಾರ್ಖಾನೆಯಿದೆ. ಅದರ ವಾರ್ಷಿಕ ಉತ್ಪಾದನೆ ಸುಮಾರು ೪೨೦ ಟನ್ನುಗಳು.
(b) ಆಧುನಿಕ ಸಂಯೋಜನಾ ವಿಧಾನಗಳು: ೧. ಜಲಾನಿಲದಿಂದ: ೨೦೦ ವಾಯು ಭಾರ ಒತ್ತಡದಲ್ಲಿ ೩೫೦೦-೪೦೦೦ ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತಾಮಿತಿಯಲ್ಲಿ ೨:೧ ಗಾತ್ರ ಪ್ರಮಾಣದ ಜಲಾನಿಲ ಮತ್ತು ಹೈಡ್ರೊಜನ್ ಮಿಶ್ರಣವನ್ನು ಸತು ಮತ್ತು ಕ್ರೋಮಿಯಂ ಆಕ್ಸೈಡುಗಳ ವೇಗವರ್ಧಕ ಮಿಶ್ರಣದ ಮೇಲೆ ಹಾಯಿಸುವರು. ಆಗ ಶುದ್ಧ ಮಿಥೆನಾಲ್ ಉಂಟಾಗುವುದು.
(CO + H2) + H2 → CH3OH
ಈ ವಿಧಾನದಿಂದ ೨೫% ಪರಿವರ್ತನೆಯನ್ನು ಸಾಧಿಸಬಹುದು. ಅಮೆರಿಕ ಸಂಯುಕ್ತ ಸಂಸ್ಥಾನದಲ್ಲಿ ನಿಸರ್ಗಾನಿಲ ಮತ್ತು ಹಬೆಯ ವರ್ತನೆಯಿಂದ ಈ ಕ್ರಿಯೆಗೆ ಅಗತ್ಯವಾದ ಅನಿಲ ಮಿಶ್ರಣವನ್ನು ಮಾಡಿಕೊಳ್ಳುತ್ತಾರೆ.
CH4 + H2O → CO + 3H2
ಆ ದೇಶದಲ್ಲಿ ಸುಮಾರು ೨೦೦ ಮಿಲಿಯನ್ ಗ್ಯಾಲನ್ ಮಿಥೆನಾಲನ್ನು ವಾರ್ಷಿಕವಾಗಿ ಹೀಗೆ ತಯಾರಿಸುತ್ತಾರೆ.
(c) ಮೀಥೇನಿನಿಂದ: ೯:೧ ಗಾತ್ರ ಪ್ರಮಾಣದ ಮೀಥೇನ್ ಮತ್ತು ಆಕ್ಸಿಜನ್ ಮಿಶ್ರಣವನ್ನು ೧೦೦ ವಾಯುಭಾರ ಒತ್ತಡದಲ್ಲಿ ೨೦೦೦ ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿಟ್ಟಿರುವ ತಾಮ್ರದ ಕೊಳವೆಯ ಮೂಲಕ ಹಾಯಿಸುವರು.
2CH4 + O2 → 2CH3OH
ಈ ವಿಧಾನದಲ್ಲಿ ೧೭% ಪರಿವರ್ತನೆ ಮಾತ್ರ ಸಾಧ್ಯ.
ಗುಣಗಳು: ಮಧುರ ವಾಸನೆ ಮತ್ತು ದಾಹಕ ರುಚಿಯುಳ್ಳ ನಿರ್ವರ್ಣ ದ್ರವ. ವಿಷವಸ್ತು. ಸೇವಿಸಿದ ಪ್ರಮಾಣಕ್ಕೆ ಅನುಗುಣವಾಗಿ ಅಂಧತ್ವ, ಹುಚ್ಚು ಅಥವಾ ಸಾವು ಸಂಭವಿಸುತ್ತವೆ. ದೇಹದಲ್ಲಿ ಅದು ಫಾರ್ಮಿಕ್ ಆಮ್ಲವಾಗಿ ಉತ್ಕರ್ಷಣ ಹೊಂದಿ ಕೆಡುಕಾಗುವುದು. ಆದ್ದರಿಂದ ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲನ್ನು ಪಾನತ್ಯಾಜ್ಯವನ್ನಾಗಿ ಮಾಡಲು ಮಿಥೆನಾಲ್ ಉಪಯೋಗಿಸುವರು. ನೀರಿನೊಂದಿಗೆ ಧಾರಾಳವಾಗಿ ಬೆರೆಯುತ್ತದೆ. ಉತ್ಕರ್ಷಿಸಿದಾಗ ಅಂತಿಮವಾಗಿ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡನ್ನು ಕೊಡುವುದು.
ಫಾರ್ಮಾಲ್ಡಿಹೈಡ್ ಫಾರ್ಮಿಕ್ ಆಮ್ಲ
ಸೋಡಿಯಂ ಲೋಹದೊಡನೆ ತೀವ್ರವಾಗಿ ವರ್ತಿಸಿ ಸೋಡಿಯಂ ಮೀಥಾಕ್ಸೈಡ್ (CH3ONa) ಕೊಡುವುದು. ಮಿಥೆನಾಲ್ ದುರ್ಬಲ ಆಮ್ಲದಂತೆ ವರ್ತಿಸುತ್ತದೆ. ಅದರ ವಿಭಜನಾಂಕ (ಡಿಸೋಸಿಯೇಷನ್ ಕಾನ್ಸ್ಟೆಂಟ್) ೧ x ೧೦-೧೭. ಮೀಥಾಕ್ಸೈಡುಗಳು ಸುಲಭವಾಗಿ ಜಲವಿಶ್ಲೇಷಣೆ ಹೊಂದುತ್ತವೆ. ಆದ್ದರಿಂದಲೇ ಮಿಥೆನಾಲಿನಲ್ಲಿರುವ ಲೇಶಮಾತ್ರ ನೀರನ್ನು ಹೀರಿಕೊಳ್ಳಲು ಮೆಗ್ನೀಸಿಯಂ ಮಿಥಾಕ್ಸೈಡ್ ಉಪಯೋಗಿಸುವುದು.
Mg(OCH3)2H2O → MgO + 2CH3OH
ಪ್ರಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದೊಡನೆ ವರ್ತಿಸಿದಾಗ ಮೊದಲು ಮೀಥೈಲ್ ಹೈಡ್ರೊಜನ್ ಸಲ್ಫೇಟ್ (CH3HSO4) ಅನಂತರ ಡೈಮೀಥೈಲ್ ಸಲ್ಫೇಟ್ [(CH3)2SO4] ಉತ್ಪತ್ತಿಯಾಗುವುವು. ಸೋಡಾಲೈಮ್ ಜೊತೆ ಕಾಸಿದಾಗ ಸೋಡಿಯಂ ಫಾರ್ಮೇಟ್ ಮತ್ತು ಹೈಡ್ರೊಜನನ್ನು ಕೊಡುತ್ತದೆ.
CH3OH + NaOH → HCOONa + 2H2
ಪರೀಕ್ಷಾ ಪ್ರಯೋಗಗಳು: ಮಿಥೆನಾಲಿಗೆ ಒಂದು ಚಿಟಕಿ ಸ್ಯಾಲಿಸಿಲಿಕ್ ಆಮ್ಲ ಎರಡು ತೊಟ್ಟು ಪ್ರಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ ಹಾಕಿ ಬೆಚ್ಚಗೆ ಮಾಡಿದರೆ ಮೀಥೈಲ್ ಸ್ಯಾಲಿಸಿಲೇಟ್ ಎಂಬ ಎಸ್ಟರಿನ ವಿಶಿಷ್ಟ ವಾಸನೆ (ಅಮೃತಾಂಜನದಂತೆ) ಬರುತ್ತದೆ. ಅಲ್ಲದೆ ಮಿಥೆನಾಲ್ ಅಯೋಡೊಫಾರಂ ಕೊಡುವುದಿಲ್ಲ. ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲಿನಿಂದ ಇದನ್ನು ಗುರುತಿಸಲು ಈ ಎರಡು ಪರಿಕ್ಷಾ ಪ್ರಯೋಗಗಳು ಉಪಯುಕ್ತ.
ಉಪಯೋಗಗಳು: ಪ್ಲ್ಯಾಸ್ಟಿಕ್ ಉತ್ಪಾದನೆಗೆ ಅಗತ್ಯವಾದ ಫಾರ್ಮಾಲ್ಡಿಹೈಡನ್ನು ತಯಾರಿಸಲು ಇದು ವಿಶೇಷವಾಗಿ ವಿನಿಯೋಗವಾಗುತ್ತದೆ. ಮೀಥೈಲ್ ಅಸಿಟೇಟ್ ಮತ್ತು ಅಸಿಟೋನಿನೊಡನೆ ಮಿಶ್ರಮಾಡಿ ಲ್ಯಾಕರುಗಳನ್ನು ಲೀನಮಾಡಲು ಉಪಯೋಗಿಸುವರು. ಮೋಟಾರ್ ವಾಹನಗಳಲ್ಲಿ ಬಳಸುವ ನೀರಿಗೆ ಇದನ್ನು ಸೇರಿಸಿದರೆ ನೀರು ಹೆಪ್ಪುಗಟ್ಟಿ ತೊಂದರೆಯಾಗುವುದಿಲ್ಲ. ಹರಳೆಣ್ಣೆ ಮತ್ತು ಸೆಲ್ಯುಲೋಸ್ ಉತ್ಪನ್ನಗಳಿಗೂ ಇದು ಲೀನಕಾರಿ. ಬಣ್ಣಗಳು, ಸುಗಂಧಗಳು, ಔಷಧಗಳು, ವಾರ್ನಿಷ್ಗಳು ಮತ್ತು ಪಾಲಿಷ್ಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಮಿಥೆನಾಲಿನ ಉಪಯೋಗ ವ್ಯಾಪಕವಾಗಿದೆ.
ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ (ಎಥೆನಾಲ್)
[ಬದಲಾಯಿಸಿ]ಮಾನೊಹೈಡ್ರಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳಲ್ಲಿ ಅತಿಮುಖ್ಯವಾದ ಈ ವಸ್ತುವನ್ನು ಕೇವಲ ಆಲ್ಕೊಹಾಲ್ ಎಂದು ಸಂಬೋಧಿಸುವುದು ರೂಢಿಯಾಗಿ ಬಿಟ್ಟಿದೆ. ಇದರ ಅಣುಸೂತ್ರ (C2H5OH). ರಚನಾ ಸೂತ್ರ ಕೆಳಕಂಡಂತಿದೆ.

ಕೈಗಾರಿಕಾ ತಯಾರಿಕೆ: ಅಗ್ಗ ಪಿಷ್ಟ ಪದಾರ್ಥಗಳಾದ ಆಲೂಗೆಡ್ಡೆ, ಮುಸುಕಿನ ಜೋಳ, ಅಕ್ಕಿ ಇತ್ಯಾದಿಗಳಿಂದ ಆಲ್ಕೊಹಾಲನ್ನು ತಯಾರಿಸುವರು. ಆಲೂಗಡ್ಡೆಯನ್ನು ತೆಳುವಾದ ಬಿಲ್ಲೆಗಳಾಗಿ ಹೆಚ್ಚಿ, ಒತ್ತಡದಲ್ಲಿ ಹಬೆಯೊಂದಿಗೆ, 1400-1500 ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿ ಕಾಸುವರು. ಇದರಿಂದ ಸೆಲ್ ಪದರಗಳು ಹರಿದು ಪಿಷ್ಟಕಣಗಳು ಹೊರಬೀಳುವುವು. ಆಗ ಹಾಲಿನಂಥ ದ್ರವವಸ್ತುವಾಗುವುದು. ಇದಕ್ಕೆ ಮ್ಯಾಷ್ ಎಂದು ಹೆಸರು. ಅನಂತರ ಇದಕ್ಕೆ ಮಾಲ್ಟ್ ಸೇರಿಸಿದರೆ ಜಲವಿಶ್ಲೇಷಣೆ ಪ್ರಾರಂಭವಾಗುವುದು. ಬಾರ್ಲಿ ಬೀಜಗಳನ್ನು ನೀರಿನಲ್ಲಿ ನೆನೆಸಿ ತೇವ ವಾತಾವರಣದಲ್ಲಿ 12 ಸೆಂ. ಮೀ. ಎತ್ತರ ಹರಡಿ 150 ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿ ಕೆಲವು ಗಂಟೆಗಳ ಕಾಲ ಬಿಡಲಾಗುವುದು. ಆಗ ಬಾರ್ಲಿ ಮೊಳಕೆ ಒಡೆಯುವುದು. ಮೊಳೆತಾಗ ಡಯಸ್ಟೇಸ್ ಎಂಬ ಕಿಣ್ವ ಉತ್ಪತ್ತಿಯಾಗುವುದು. ಕಾಳು ಸಾಕಷ್ಟು ಮೊಳೆತ ಅನಂತರ ಅದನ್ನು ಇನ್ನೊಂದು ಕೋಶಕ್ಕೆ ರವಾನಿಸಿ ಹೆಚ್ಚಿನ ಉಷ್ಣತೆಗೆ ಕಾಸಿದರೆ ಮೊಳೆಯುವಿಕೆ ನಿಲ್ಲುವುದು. ಅಂಥ ಕಾಳುಗಳನ್ನು ಒಣಗಿಸಿದರೆ ಲಭಿಸುವುದೇ ಮಾಲ್ಟ್. ಇದನ್ನು ಮ್ಯಾಷ್ ಗಂಜಿಗೆ ಸೇರಿಸಿ ಅದರ ಉಷ್ಣತೆಯನ್ನು 500 ಸೆಂ.ಗ್ರೇಡಿಗೆ ಹೆಚ್ಚಿಸಲಾಗುವುದು. ಫರ್ಮೆಂಟೇಷನ್ ಆರಂಭವಾಗಿ ಪಿಷ್ಟದ ಬಹುಭಾಗ ಮಾಲ್ಟೋಸ್ ಸಕ್ಕರೆಯಾಗಿ ಪರಿವರ್ತಿತವಾಗುತ್ತದೆ. ಕೊಂಚ ಡೆಕ್ಸ್ಟ್ರಿನ್ ಸಹ ಬರಬಹುದು. ಮಾಲ್ಟಿನಲ್ಲಿರುವ ಜಲವಿಶ್ಲೇಷಣಕಾರಿಯಾದ ಡಯಸ್ಟೇಸ್ ಕಿಣ್ವ ಈ ಪರಿವರ್ತನೆಗೆ ಕಾರಣ. ಕ್ರಿಯೆ ಸುಮಾರು ಅರ್ಧ ತಾಸಿನಲ್ಲಿ ಪೂರ್ಣಗೊಳ್ಳುವುದು.
ಸಕ್ಕರೆಯ ದ್ರಾವಣವನ್ನು (ವೋರ್ಟ್) 150 ಸೆಂ.ಗ್ರೇಡಿಗೆ ತಣಿಸಿ ಯೀಸ್ಟ್ ಸೇರಿಸುವರು. ಬಹುತೇಕ ಯೀಸ್ಟ್ಗಳಲ್ಲಿರುವ ಮಾಲ್ಟೇಸ್ ಕಿಣ್ವ ಮಾಲ್ಟೋಸನ್ನು ಗ್ಲೂಕೋಸಿಗೆ ಮಾರ್ಪಡಿಸುವುದು. ಯೀಸ್ಟ್ನಲ್ಲಿರುವ ಮತ್ತೊಂದು ಕಿಣ್ವವಾದ ಜೈಮೇಸ್ ಗ್ಲೂಕೋಸನ್ನು ಆಲ್ಕೊಹಾಲಿಗೆ ಪರಿವರ್ತಿಸುತ್ತದೆ. ಈ ಕ್ರಿಯೆ ಪೂರ್ತಿಯಾಗಲು ಸುಮಾರು ನಾಲ್ಕು ದಿವಸಗಳು ಬೇಕು. ಆಗ ಉಷ್ಣತೆ 330 ಸೆಂ.ಗ್ರೇ. ಮೀರದಂತೆ ನೋಡಿಕೊಳ್ಳುವುದು ಅಗತ್ಯ. ಫರ್ಮೆಂಟ್ ಮಾಡುತ್ತಿರುವ ಯೀಸ್ಟನ್ನು ಗಾಳಿಗೆ ಒಡ್ಡಿದರೆ ಕ್ರಿಯೆ ನಿಲ್ಲುವುದು. ಶ್ವಾಸಕ್ರಿಯೆ ಪ್ರಾರಂಭವಾಗಿ, ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಮತ್ತು ನೀರು ಉತ್ಪತ್ತಿಯಾಗುವುವೇ ವಿನಾ ಸಕ್ಕರೆ ಆಲ್ಕೊಹಾಲ್ ಆಗುವುದಿಲ್ಲ. ಲಭ್ಯವಾದ ದ್ರವವನ್ನು ಭಟ್ಟಿ ಇಳಿಸಿದರೆ ಜಲಮಿಶ್ರಿತ ಆಲ್ಕೊಹಾಲ್ ದೊರೆಯುವುದು. ಇಲ್ಲಿಯವರೆಗೆ ವಿವರಿಸಿದ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳು ಕೆಳಕಂಡ ಸಮೀಕರಣಗಳಲ್ಲಿ ಸೂಚಿತವಾಗಿದೆ.
2[C6H10O5]n + nH2O → nC12H22O11
ಮಾಲ್ಟೋಸ್
C12H22O11 + H2O → 2C6H12O6
ಗ್ಲೂಕೋಸ್
C6H12O6 → 2C2H5OH + 2CO2 ↑
ಆಲ್ಕೊಹಾಲ್
ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಹೊರಬೀಳುವ ರಭಸಕ್ಕೆ ದ್ರವ ಕುದಿಯುವಂತೆ ಭಾಸವಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ ಕುದಿ ಎಂಬ ಅರ್ಥವುಳ್ಳ (fervere) ಲ್ಯಾಟಿನ್ ಪದದ ಆಧಾರದ ಮೇಲೆ ಈ ಕ್ರಿಯೆಗೆ ಫರ್ಮೆಂಟೇಷನ್ ಎಂದು ಹೆಸರಿಡಲಾಯಿತು. (ಈ ಪದಕ್ಕೆ ಈಗ ವಿಸ್ತಾರವಾದ ಅರ್ಥವಿದೆ). ಆಲ್ಕೊಹಾಲಿನ ಅಂಶ 14% ಮುಟ್ಟಿದ ಕೂಡಲೆ ಯೀಸ್ಟ್ ಹತವಾಗುವುದರಿಂದ ಈ ವಿಧಾನದಿಂದ ಜಲಮಿಶ್ರಿತ ಆಲ್ಕೊಹಾಲನ್ನು ಮಾತ್ರ ತಯಾರಿಸಲು ಸಾಧ್ಯ.
ಫರ್ಮೆಂಟಾದ ಮದ್ಯಸಾರವನ್ನು ವಾಷ್ ಎನ್ನುವರು. ಇದರಲ್ಲಿ ಸಾಮಾನ್ಯವಾಗಿ 8-10% ಆಲ್ಕೊಹಾಲಿರುತ್ತದೆ. ಇದನ್ನು ಕಾಫೆಯ ಸಾಂದ್ರಕದಲ್ಲಿ ಭಟ್ಟಿ ಇಳಿಸಿದರೆ ಒಂದೇ ಸಲಕ್ಕೆ 80-90% ಆಲ್ಕೊಹಾಲ್ ದೊರೆಯುತ್ತವೆ. ಕಾಫೆಯ ಸಾಂದ್ರಕದಲ್ಲಿ ಎರಡು ಸ್ತಂಭಗಳಿಗೆ ಒಂದಕ್ಕೆ ವಿಶ್ಲೇಷಕವೆಂದೂ ಇನ್ನೊಂದಕ್ಕೆ ಶುದ್ಧಿಕಾರಕ (ರೆಕ್ಟಿಫಯರ್) ಎಂದೂ ಹೆಸರು. ಇವುಗಳ ಮೂಲಕ ವಿರುದ್ಧ ದಿಕ್ಕುಗಳಲ್ಲಿ ಹಬೆ ಮತ್ತು ಆಲ್ಕೊಹಾಲ್ಗಳು ಹಾಯುತ್ತಿರುತ್ತವೆ. ವಿಶ್ಲೇಷಕದಲ್ಲಿ ಆಲ್ಕೊಹಾಲೆಲ್ಲ ಹಬೆಯೊಡಗೂಡಿ ಶುದ್ಧಿಕಾರಕದ ಮೇಲ್ಭಾಗದಲ್ಲಿ ಸಾಂದ್ರೀಕರಿಸಿ ಅಲ್ಲಿಂದ ಸಂಗ್ರಾಹಕಗಳಿಗೆ ತಲಪುವುದು. ಇದನ್ನೇ ಶುದ್ಧೀಕರಿಸಿದ ಸ್ಪಿರಿಟ್ ಎನ್ನುವುದು. ಇದರಲ್ಲಿ ತೂಕ ರೀತ್ಯಾ 95.6% ಆಲ್ಕೊಹಾಲ್ ಇರುತ್ತದೆ. ಫರ್ಮೆಂಟೇಷನ್ ಕ್ರಿಯೆಯಲ್ಲಿ ಆಲ್ಕೊಹಾಲಿನ ಜೊತೆಯಲ್ಲಿ ವಿವಿಧ ಪ್ರಮಾಣದಲ್ಲಿ ಫ್ಯೂಸಲ್ ಆಯಿಲ್, ಗ್ಲಿಸರಾಲ್, ಅಸಿಟಾಲ್ಡಿಹೈಡ್, ಅಸಿಟೋನ್, ಸಕ್ಸಿನಿಕ್ ಆಮ್ಲ ಮುಂತಾದ ಉಪ ವಸ್ತುಗಳು ದೊರೆಯುತ್ತವೆ. ಅಂಶಬಾಷ್ಪೀಕರಣ ಮಾಡಿದಾಗ ಇವೆಲ್ಲ ನಿವಾರಿಸಲ್ಪಡುತ್ತವೆ. ಪಿಷ್ಟದಿಂದ ತಾತ್ವಿಕವಾಗಿ ಪಡೆಯಬಹುದಾದ ಆಲ್ಕೊಹಾಲಿನ 85% ಭಾಗ ಮಾತ್ರ ವಾಸ್ತವಿಕವಾಗಿದೆಯೆಂಬುದು ಅನುಭವಸಿದ್ಧ. ಭಾರತದಲ್ಲಿ ಮದ್ಯಪಾನಕ್ಕೆ ಒದಗಿಸುವ ಆಲ್ಕೊಹಾಲನ್ನು ಗ್ಲೂಕೋಸ್ ಮತ್ತು ಫ್ರಕ್ಟೋಸ್ ಸಕ್ಕರೆಗಳ ಅಂಶ ಅಧಿಕವಾಗಿರುವ ಮಾಹ್ವ (ಬ್ಯಾನಿಯ ಲ್ಯಾಟಿಫೋಲಿಯಾ) ಪುಷ್ಪಗಳನ್ನು ಫರ್ಮೆಂಟ್ ಮಾಡಿ ತಯಾರಿಸುತ್ತಾರೆ. ಕಾಗದ ತಯಾರಿಸಲು ಸಲ್ಫೇಟ್ ವಿಧಾನವೆಂಬ ಕ್ರಮವಿದೆ. ಆಗ ಉಳಿಯುವ ನಿರುಪಯೋಗಿ ದ್ರವದಲ್ಲಿ ಫರ್ಮೆಂಟ್ ಮಾಡಲು ಯೋಗ್ಯವಾದ ಸಕ್ಕರೆಗಳಿರುತ್ತವೆ. ಅದರಿಂದಲೂ ಆಲ್ಕೊಹಾಲನ್ನು ತಯಾರಿಸುವ ಪದ್ಧತಿ ಸ್ವೀಡನ್ನಿನಲ್ಲಿ ರೂಢಿಯಲ್ಲಿದೆ.
ಆಬ್ಸೊಲ್ಯೂಟ್ ಆಲ್ಕೊಹಾಲ್: ಕೇವಲ ಕುದಿಸುವುದರಿಂದ 100% ಆಲ್ಕೊಹಾಲನ್ನು ಪಡೆಯಲು ಸಾಧ್ಯವಿಲ್ಲ. 78.130 ಸೆಂ.ಗ್ರೇ.ನಲ್ಲಿ ತೂಕ ರೀತ್ಯಾ 4.43% ಜಲಾಂಶವಿರುವ ನಿಯತ ಕುದಿಮಿಶ್ರಣವಾಗುವುದೇ (ಕಾನ್ಸ್ಟೆಂಟ್ ಬಾಯ್ಲಿಂಗ್ ಮಿಕ್ಸ್ಚರ್) ಇದಕ್ಕೆ ಕಾರಣ. ಆದರೆ ಶುದ್ಧ ಸುಣ್ಣದೊಡನೆ ಕುದಿಸಿದರೆ 0.3% ನೀರುಮಾತ್ರ ಉಳಿಯುವುದು. ವ್ಯವಹಾರದಲ್ಲಿ ಆಬ್ಸೊಲ್ಯೊಟ್ ಆಲ್ಕೊಹಾಲ್ ಎನ್ನುವುದು ಇದನ್ನೇ. ಶೇಷಜಲವನ್ನು ತೊಡೆದುಹಾಕಲು, ಕ್ಯಾಲ್ಸಿಯಂ ಅಥವಾ ಮೆಗ್ನೀಸಿಯಂ ಸೇರಿಸಿ ಕುದಿಸಬೇಕು.
ಬಳಕೆಯಲ್ಲಿರುವ ಮತ್ತೊಂದು ಜರ್ಮನ್ ವಿಧಾನದಲ್ಲಿ ಅಗತ್ಯವಿದ್ದಷ್ಟು ಮಾತ್ರ ಬೆಂಜೀನನ್ನು ಸೇರಿಸಿ ಕುದಿಸಲಾಗುವುದು. ಆಗ 64.90 ಸೆಂಟಿಗ್ರೇಡಿನಲ್ಲಿ ಬೆಂಜೀನ್ ಮತ್ತು ಸ್ವಲ್ಪ ಆಲ್ಕೊಹಾಲ್ ನೀರನ್ನೆಲ್ಲ ಹೊತ್ತು ಹಾಕುತ್ತವೆ. ಉಳಿದ ಬೆಂಜೀನ್ ಇನ್ನಷ್ಟು ಆಲ್ಕೊಹಾಲಿನೊಂದಿಗೆ 68.250 ಸೆಂ.ಗ್ರೇ. ನಲ್ಲಿ ನಿಯತ ಕುದಿಮಿಶ್ರಣವಾಗಿ ಆವಿಯಾಗುತ್ತದೆ. ಹಿಂದುಳಿಯುವ 100% ಆಲ್ಕೊಹಾಲ್ 78.30 ಸೆಂ.ಗ್ರೇ. ನಲ್ಲಿ ಭಟ್ಟಿ ಇಳಿಯುತ್ತದೆ. ಬೆಂಜೀನನ್ನು ಸಂಗ್ರಹಿಸಿ ಪುನಃ ಉಪಯೋಗಿಸಲಾಗುವುದು. ಆಲ್ಕೊಹಾಲಿನಲ್ಲಿರುವ ಜಲಾಂಶವೆಲ್ಲ ಹೋಗಿದೆಯೇ ಎಂಬುದನ್ನು ಪರೀಕ್ಷಿಸಲು ನಿರ್ಜಲ ತಾಮ್ರದ ಸಲ್ಫೇಟ್ (ನೀಲಿಯಾಗುತ್ತದೆ) ಅಥವಾ ಕ್ಯಾಲ್ಸಿಯಂ ಕಾರ್ಬೈಡ್ (ಅಸಿಟಲಿನ್ ಅನಿಲ ಬರುತ್ತದೆ) ಉಪಯೋಗಿಸಬಹುದು. ಅತಿ ಶುದ್ಧ ಆಲ್ಕೊಹಾಲಿಗೆ ವಿಪರೀತ ಬೇಡಿಕೆಯಿದೆ.
ಕಾಕಂಬಿಯಿಂದ ಆಲ್ಕೊಹಾಲ್: ಕಬ್ಬಿನ ಅಥವಾ ಬೀಟ್ ಸಕ್ಕರೆಯ ತಯಾರಿಕೆಯಲ್ಲಿ ಉಳಿಯುವ ಕಾಕಂಬಿಯಲ್ಲಿ 30% ಸುಕ್ರೋಸ್ ಮತ್ತು 32% ಗ್ಲೂಕೋಸ್ ಫ್ರಕ್ಟೋಸ್ಗಳು ಇರುತ್ತವೆ. ಮೊದಲು ಕಾಕಂಬಿಯ ಪಾಕಕ್ಕೆ ನೀರು ಸೇರಿಸಿ 10% ಸಕ್ಕರೆಯ ದ್ರಾವಣ ಮಾಡಿಕೊಳ್ಳುವರು. ಅನಂತರ ಯೀಸ್ಟ್ ಒದಗಿಸುವರು. ಅದರಲ್ಲಿರುವ ಇನ್ವರ್ಟೇಸ್ ಕಿಣ್ವ ಸುಕ್ರೋಸನ್ನು ಗ್ಲೂಕೋಸಾಗಿ ಮಾಡುವುದು. ಕ್ರಿಯಾ ಮಾಧ್ಯಮದಲ್ಲಿ ಸಾಕಷ್ಟು ಯೀಸ್ಟ್ ಆಹಾರವಿಲ್ಲದಿದ್ದರೆ ಅಮೋನಿಯಂ ಸಲ್ಫೇಟ್ನಂಥ ಪೋಷಕ ದ್ರಾವಣವನ್ನು ಕೊಡಿಸುವರು. ಸ್ವಲ್ಪ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ ಹಾಕಿದರೆ ಬ್ಯಾಕ್ಟೀರಿಯಾ ಚಟುವಟಿಕೆ ನಿಧಾನವಾಗಿ ಯೀಸ್ಟ್ ತೀವ್ರಗತಿಯಲ್ಲಿ ವೃದ್ಧಿಯಾಗುವುದು. ಮರದ ಅಥವಾ ಗಾಜುಲೇಪನ (ಎನಾಮೆಲ್) ಮಾಡಿದ ಕಬ್ಬಿಣದ ಕಡಾಯಿಗಳಲ್ಲಿ ಈ ಕ್ರಿಯೆ ನಡೆಸಲಾಗುವುದು. ದ್ರವ ಮಿಶ್ರಣದ ಒಟ್ಟು ಗಾತ್ರದ 5% ಮಾತ್ರ ಯೀಸ್ಟ್ ಇದ್ದರೆ ಉತ್ತಮ. ಉಷ್ಣತೆ 210-37.80 ಸೆಂ.ಗ್ರೇ. ಮಿತಿಯಲ್ಲಿರಬೇಕು. ಇದು ಉಷ್ಣಜನಕ ಕ್ರಿಯೆ. ಸಾಮಾನ್ಯವಾಗಿ 3-4 ದಿವಸಗಳಲ್ಲಿ ಪೂರ್ತಿಯಾಗುವುದು. ಅನುಕೂಲ ಪರಿಸ್ಥಿತಿಯಿದ್ದರೆ 36 ಗಂಟೆಗಳಲ್ಲಿ 90% ಸಕ್ಕರೆ ಫರ್ಮೆಂಟಾಗಬಹುದು. ಜಲಮಿಶ್ರಿತ ಆಲ್ಕೊಹಾಲನ್ನು ಹಿಂದೆ ಹೇಳಿದಂತೆ ಸಾಂದ್ರೀಕರಿಸಬಹುದು. ಒಂದು ಗ್ಯಾಲನ್ ಕಾಕಂಬಿಯಿಂದ ಸುಮಾರು 0.4 ಗ್ಯಾಲನ್ ರೆಕ್ಟಿಫೈಡ್ ಸ್ಪಿರಿಟ್ ಪಡೆಯಲು ಸಾಧ್ಯ. 1960ರಲ್ಲಿ ಕಾಕಂಬಿಯಿಂದ 484.21 ಲಕ್ಷ ಗ್ಯಾಲನ್ ಇಂಧನ ಆಲ್ಕೊಹಾಲ್, 337.05 ಲಕ್ಷ ಗ್ಯಾಲನ್ ರೆಕ್ಟಿಫೈಡ್ ಸ್ಪಿರಿಟ್ ಮತ್ತು 252.85 ಲಕ್ಷ ಗ್ಯಾಲನ್ ಪಾನತ್ಯಾಜ್ಯ ಸ್ಪಿರಿಟ್ಗಳನ್ನು ಭಾರತದಲ್ಲಿ ಉತ್ಪಾದಿಸಲಾಯಿತು. ಪಾಲಿಥೀನ್ ಪ್ಲಾಸ್ಟಿಕ್ ತಯಾರಿಸಲು ಎಥಿಲೀನ್ ಬೇಕು. ಇದನ್ನು ಪಡೆಯಲು ನಾವು ಫರ್ಮೆಂಟೇಷನ್ ವಿಧಾನದಿಂದ ಬಂದ ಆಲ್ಕೊಹಾಲನ್ನು ಬಳಸುತ್ತಿದ್ದೇವೆ.
ಆಲ್ಕೊಹಾಲಿಕ್ ಫರ್ಮೆಂಟೇಷನ್ನಿನಿಂದ ದೊರೆಯುವ ಉಪವಸ್ತುಗಳ ಕಾರ್ಬನ್ ಡಯಾಕ್ಸೈಡನ್ನು ಘನೀಭವಿಸಿ ಒಣಗಿದ ಮಂಜುಗಡ್ಡೆಯನ್ನಾಗಿ ಮಾಡಬಹುದು ಅಥವಾ ಮಿಥೆನಾಲಿಗೆ ಪರಿವರ್ತಿಸಬಹುದು. ಒಂದು ಟನ್ ಕಾಕಂಬಿಯಿಂದ 520 ಪೌಂಡುಗಳಷ್ಟು ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಸಿಗುತ್ತದೆ. ಕಂದುಬಣ್ಣದ ಘನವಾಗಿ ಶೇಖರಿಸುವ ಟಾರ್ಟರ್ನಿಂದ ಟಾರ್ಟಾರಿಕಾಮ್ಲ ಮತ್ತು ರಾಷೆಲೆ ಲವಣಗಳನ್ನು ಮಾಡಿಕೊಳ್ಳಬಹುದು. ಸಾಂದ್ರೀಕರಣದ ಕಡೆಯ ಹಂತಗಳಲ್ಲಿ ದಟ್ಟ ಹಳದಿಬಣ್ಣದ ತೈಲದಂತಿರುವ ದ್ರವವಸ್ತು ಬರುವುದು. ಇದೇ ಫ್ಯೂಸೆಲ್ ಆಯಿಲ್. ಪಿಷ್ಟದಲ್ಲಿ ಕೆಲವು ಪ್ರೋಟೀನುಗಳಿವೆ. ಅವುಗಳಿಂದ ವ್ಯಾಲೆನ್ ಮತ್ತು ಲ್ಯೊಸೀನ್ ಎಂಬ ಅಮೈನೊ ಆಮ್ಲಗಳು ಉದ್ಭವಿಸುತ್ತವೆ. ಇವುಗಳೊಡನೆ ಯೀಸ್ಟ್ ವರ್ತಿಸಿ ಐಸೊ ಆಮೈಲ್, ಐಸೊ ಬ್ಯೂಟೈಲ್, ನಾರ್ಮಲ್ ಪ್ರೊಪೈಲ್ ಮುಂತಾದ ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಕೊಡುತ್ತವೆ. ಇವುಗಳ ಮಿಶ್ರಣವೇ ಫ್ಯೂಸೆಲ್ ಆಯಿಲ್. ಅದರಿಂದ ಕೈಗಾರಿಕಾ ಪ್ರಾಮುಖ್ಯವಿರುವ ಅಮೈಲ್ ಆಲ್ಕೊಹಾಲ್ ತಯಾರಿಸಬಹುದು. ಇದು ಉಪಯುಕ್ತ ದ್ರಾವಕ. ಇದರ ಎಸ್ಟರಾದ ಅಮೈಲ್ ಅಸಿಟೇಟಿಗೆ ಬಾಳೆಯ ಹಣ್ಣಿನ ರುಚಿ ವಾಸನೆಗಳಿವೆ. ಆದ್ದರಿಂದ ಹಣ್ಣಿನ ಸಾರ ತಯಾರಿಕೆಯಲ್ಲಿ ಅದಕ್ಕೆ ಮಹತ್ತ್ವವಿದೆ.
ಆಲ್ಕೊಹಾಲ್ ತಯಾರಿಸುವ ಆಧುನಿಕ ಸಂಯೋಜನಾ ವಿಧಾನಗಳು: ಅಪರ್ಯಾಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳಿಂದ ಆಲ್ಕೊಹಾಲನ್ನು ತಯಾರಿಸಬಹದೆಂದು ಹಿಂದೆಯೆ ತಿಳಿಸಿದೆಯಷ್ಟೆ. ಈ ತತ್ತ್ವದ ಆಧಾರದ ಮೇಲೆ ಕೆಳಕಂಡ ವಿಧಾನಗಳು ರೂಪಿತವಾಗಿವೆ.
೧. ಅಸಿಟಲೀನ್ ಅನಿಲದಿಂದ : ೬೦೦ ಸೆಂ.ಗ್ರೇ. ನಲ್ಲಿರುವ ದುರ್ಬಲ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ ಮತ್ತು ಮರ್ಕ್ಯೂರಿಕ್ ಸಲ್ಫೇಟಿನ (ವೇಗವರ್ಧಕ) ಮಿಶ್ರಣದ ಮೂಲಕ ಒತ್ತಡದಲ್ಲಿ ಅಸಿಟಲೀನ್ ಹಾಯಿಸಲಾಗುವುದು. ಆಗ ಅದು ನೀರನ್ನು ಮಾತ್ರ ಹೀರಿಕೊಂಡು ಅಸಿಟಾಲ್ಡಿಹೈಡ್ ಆಗುತ್ತದೆ. ಇದನ್ನು ನಿಕ್ಕಲ್ ವೇಗ ವರ್ಧಕದ ಸಂಪರ್ಕದಲ್ಲಿ ೧೦೦೦-೧೪೦೦ ಸೆಂ.ಗ್ರೇ.ನಲ್ಲಿ ಹೈಡ್ರೊಜನ್ನಿಂದ ಅಪಕರ್ಷಿಸಿದರೆ ಎಥೆನಾಲ್ ಉಂಟಾಗುವುದು. ಈ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳನ್ನು ಸಮೀಕರಣಗಳ ರೂಪದಲ್ಲಿ ಕೆಳಗೆ ಕೊಡಲಾಗಿದೆ.
೨. ಎಥಿಲೀನ್ ಅನಿಲದಿಂದ: ಪೆಟ್ರೋಲಿಯಂ ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳನ್ನು ವಿಭಜಿಸಿ ಪೆಟ್ರೋಲನ್ನು ತಯಾರಿಸುವಾಗ ಎಥಿಲೀನ್ ಉಪವಸ್ತುವಾಗಿ ಬರುತ್ತದೆ. ಇದನ್ನು ೭೦೦-೮೦೦ ಸೆಂ.ಗ್ರೇ.ನಲ್ಲಿ ಚದರ ಇಂಚಿಗೆ ೨೦೦-೫೦೦ ಪೌಂಡುಗಳಷ್ಟು ಒತ್ತಡ ಹೇರಿ ೯೮% ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದ ಮೂಲಕ ಹಾಯಿಸಿದರೆ ಈಥೈಲ್ ಹೈಡ್ರೊಜನ್ ಸಲ್ಫೇಟಾಗುವುದು. ಇದಕ್ಕೆ ಸಮಾನ ಗಾತ್ರದ ನೀರನ್ನು ಸೇರಿಸಿದರೆ, ಆಲ್ಕೊಹಾಲ್ ಮತ್ತು ಕೊಂಚ ಈಥರ್ ಉತ್ಪತ್ತಿಯಾಗುವುವು. ಕುದಿಸಿದರೆ ಈಥರ್ ನಿವಾರಣೆಯಾಗುವುದು.
ಈ ಎರಡು ವಿಧಾನಗಳಿಂದ ಲಭ್ಯವಾದ, ಜಲಮಿಶ್ರಿತ ಆಲ್ಕೊಹಾಲನ್ನು ಕಾಫೆ ಸಾಂದ್ರಕದಲ್ಲಿ ಕುದಿಸುವುದರಿಂದ ಎಂದಿನಂತೆ ರೆಕ್ಟಿಫೈಡ್ ಸ್ಪಿರಿಟ್ ದೊರೆಯುವುದು.
ಆಲ್ಕೊಹಾಲನ್ನು ಒಳಗೊಂಡ ಮಾದಕ ಪಾನೀಯಗಳು: ಫರ್ಮೆಂಟೇಷನ್ ವಿಧಾನದಿಂದ ನೇರವಾಗಿ ತಯಾರಿಸಿದ ಮದ್ಯಗಳಲ್ಲಿ ಆಲ್ಕೊಹಾಲಿನ ಅಂಶ ಕಡಿಮೆ. ಭಟ್ಟಿ ಇಳಿಸಿದರೆ ಅದರ ಅಂಶ ಹೆಚ್ಚು. ಹೀಗೆ ಮಾದಕ ಪಾನೀಯಗಳನ್ನು ಭಟ್ಟಿ ಇಳಿಸದ ಮತ್ತು ಭಟ್ಟಿ ಇಳಿಸಿದ ಮದ್ಯಗಳೆಂದು ವಿಂಗಡಿಸುವುದು ವಾಡಿಕೆ. ಈ ಪಾನೀಯಗಳಲ್ಲಿ ಬಹ್ವಂಶ ನೀರು, ಬಣ್ಣ, ರುಚಿ ನೀಡುವ ವಸ್ತುಗಳನ್ನೂ ಸೇರಿಸಿರುವುದುಂಟು. ಪೋರ್ಟ್, ಷರ್ರೀ, ಷ್ಯಾಂಪೇನ್ ಎಂಬ ಪಾನೀಯಗಳು ವೈನಿಗೆ ಆಲ್ಕೊಹಾಲ್ ಸೇರಿಸಿದ ಮದ್ಯಗಳು. ಇವನ್ನು ಸಂರಕ್ಷಿತ ಮದ್ಯಗಳು (ಫಾರ್ಟಿಫೈಡ್ ಲಿಕ್ಕರ್ಸ್) ಎನ್ನುತ್ತಾರೆ. ಮುಖ್ಯವಾದ ಮಾದಕ ಪಾನೀಯಗಳನ್ನು ಕೆಳಗೆ ಪಟ್ಟಿ ಮಾಡಲಾಗಿದೆ.
| ಹೆಸರು | ಮೂಲ | ಆಲ್ಕೊಹಾಲಿನ
ಶೇಕಡಾಂಶ |
|---|---|---|
| ಭಟ್ಟಿ ಇಳಿಸಿದ ಮದ್ಯಗಳು | ||
| ವಿಸ್ಕಿ | ಮಾಲ್ಟ್ | ೩೫-೪೦ |
| ರಮ್ | ಕಾಕಂಬಿ | ೩೫-೪೦ |
| ಬ್ರಾಂದಿ | ದ್ರಾಕ್ಷಾರಸ | ೪೦-೫೦ |
| ಜಿನ್ | ಮುಸುಕಿನ ಜೋಳ | ಸುಮಾರು ೫೦ |
| ಭಟ್ಟಿ ಇಳಿಸದ ಮದ್ಯಗಳು | ||
| ಬೀರ್ | ಮಾಲ್ಟ್ | ೩-೬ |
| } | ||
| ಏಲ್ | ||
| ವೈನ್ಗಳು | ದ್ರಾಕ್ಷಾರಸ | ೮-೧೨ |
| ಪೋರ್ಟ್ | ||
| } | ದ್ರಾಕ್ಷಾರಸ | ೧೪-೨೦ |
| ಷೆರ್ರಿ | ||
| ಸೆಡರ್ | ಸೇಬಿನ ರಸ | ೪-೮ |
ಪಾನೀಯವಾಗಿ ಬಳಸುವ ಆಲ್ಕೊಹಾಲಿನ ಮೇಲೆ ಅಧಿಕ ತೆರಿಗೆ ಹೇರುತ್ತಾರೆ. ವೈಜ್ಞಾನಿಕ ಮತ್ತು ಗೃಹಬಳಕೆಗೆ ಒದಗಿಸುವ ಆಲ್ಕೊಹಾಲ್ ಅಗ್ಗ. ಇಂಥ ಆಲ್ಕೊಹಾಲನ್ನು ಪಾನೀಯವಾಗಿ ದುರುಪಯೋಗ ಮಾಡಿಕೊಳ್ಳುವ ಸಂಭವವಿದೆ. ಆದ್ದರಿಂದ ಅದನ್ನು ಪಾನತ್ಯಾಜ್ಯವನ್ನಾಗಿ ಮಾಡಲು ಕೆಲವು ಅಸಹ್ಯ ವಿಷವಸ್ತುಗಳನ್ನು ಸೇರಿಸುತ್ತಾರೆ. ಇವುಗಳ ಪೈಕಿ ೧೦% ಮಿಥೆನಾಲ್, ಪಿರಡಿನ್, ಪೆಟ್ರೋಲಿಯಂ, ನ್ಯಾಫ್ತ, ವಲ್ಕನೈಸ್ಡ್ ರಬ್ಬರನ್ನು ಕಾಸಿ ಪಡೆದ ಕಾಟ್ ಜೌಸಿನ್ (ಭಾರತದಲ್ಲಿ ಬಳಸುವುದು ಇದನ್ನೇ) ಹೆಸರಿಸಬಹುದು.
ಇಂಧನ ಆಲ್ಕೊಹಾಲ್: ವಿಶ್ವದ ಪೆಟ್ರೊಲಿಯಂ ಸಂಗ್ರಹ ತೀರಿಹೋಗುತ್ತಿದೆ. ಸಂಯೋಜಿತ ಪೆಟ್ರೋಲ್ ಈ ಕೊರತೆಯನ್ನು ಸ್ವಲ್ಪ ನೀಗುತ್ತದೆ. ಬೆಂಜೀನ್ ಮತ್ತು ಆಲ್ಕೊಹಾಲ್ ಮಿಶ್ರಿತ ಪೆಟ್ರೋಲ್ ಉಪಯುಕ್ತ ಇಂಧನ. ಶುದ್ಧ ಆಲ್ಕೊಹಾಲ್ ಪೆಟ್ರೋಲಿನೊಡನೆ ಬೆರೆಯುತ್ತದೆ. ಆದರೆ ರೆಕ್ಟಿಫೈಡ್ ಸ್ಪಿರಿಟ್ ಬೆರೆಯುವುದಿಲ್ಲ. ಅದಕ್ಕಾಗಿ ಈಥರ್, ಬೆಂಜೀನ್ ಅಥವಾ ಟೆಟ್ರಲಿನ್ ಸೇರಿಸುತ್ತಾರೆ. ಜರ್ಮನಿ, ಇಟಲಿ ಮತ್ತು ಫ್ರಾನ್ಸ್ ದೇಶಗಳಲ್ಲಿ ಪೆಟ್ರೋಲಿಗೆ ೨೦-೩೦% ಆಲ್ಕೊಹಾಲನ್ನು ಸೇರಿಸಲೇಬೇಕೆಂಬ ನಿಯಮವಿದೆ. ಭಾರತದ ಪೆಟ್ರೋಲಿಯಂ ನಿಕ್ಷೇಪವೂ ಸೀಮಿತವಾಗಿದೆ. ಕಾಕಂಬಿಯಿಂದ ಆಲ್ಕೊಹಾಲ್ ತಯಾರಿಸಿದರೆ ಪರಿಸ್ಥಿತಿ ಸುಧಾರಿಸೀತು.
ಪ್ರೂಫ್ ಸ್ಪಿರಿಟ್: ಈ ಪದ ಹುಟ್ಟಿದ್ದು ಹೀಗೆ. ಕೋವಿ ಮಸಿಯ (ಗನ್ ಪೌಡರ್) ಮೇಲೆ ವಿಸ್ಕಿ ಸುರಿದು ಅನಂತರ ಅದನ್ನು ಹೊತ್ತಿಸಲಾಗುತ್ತಿತ್ತು. ಆಲ್ಕೊಹಾಲೆಲ್ಲ ದಹಿಸಿದ ಒಡನೆ ಕೋವಿಮಸಿಯೂ ಹೊತ್ತಿಕೊಂಡರೆ ವಿಸ್ಕಿಯಲ್ಲಿ ಅಷ್ಟೇನೂ ನೀರಿಲ್ಲವೆಂಬುದಕ್ಕೆ ಇದು ಸಾಕ್ಷಿ ಎಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತಿತ್ತು. ಆದ್ದರಿಂದ ಘನ ಅಳತೆಗಳಲ್ಲಿ ೫೭.೧% ಇರುವ ಆಲ್ಕೊಹಾಲನ್ನು ‘ಫ್ರೂಫ್’ ಸ್ಪಿರಿಟ್ ಎಂದು ಕರೆದರು. ಈ ಪದ ಪ್ರಯೋಗ ಇನ್ನೂ ರೂಢಿಯಲ್ಲಿದೆ.
ಆಲ್ಕೊಹಾಲಿಗೆ ನೀರು ಬೆರೆತಾಗ ಗಾತ್ರ ಕುಗ್ಗುತ್ತದೆ. ವಿವಿಧ ಪ್ರಮಾಣದ ಆಲ್ಕೊಹಾಲ್- ನೀರಿನ ಮಿಶ್ರಣಗಳ ಸಾಪೇಕ್ಷ ಸಾಂದ್ರತೆಯನ್ನು ಸೂಚಿಸುವ ಕೋಷ್ಟಕಗಳಿವೆ. ಪ್ರಯೋಗಕ್ಕೆ ಒಳಪಟ್ಟ ಆಲ್ಕೋಹಾಲಿನ ಸಾಪೇಕ್ಷ ಸಾಂದ್ರತೆಯನ್ನು ಕಂಡುಹಿಡಿದು ಕೋಷ್ಟಕದ ಸಹಾಯದಿಂದ ಅದರಲ್ಲಿರುವ ಜಲಾಂಶವನ್ನು ನಿಖರವಾಗಿ ತಿಳಿಯಬಹುದು. ಸೇಂದಿ ಇಲಾಖೆಯವರು ಒಂದು ಬಗೆಯ ಹೈಡ್ರೊಮೀಟರ್ ಉಪಯೋಗಿಸುತ್ತಾರೆ. ಅದು ಆಲ್ಕೊಹಾಲಿನ ಶೇಕಡಾಂಶವನ್ನು ಪ್ರೂಫ್ ಸ್ಪಿರಿಟ್ ಮಾನದಲ್ಲಿ ನೇರವಾಗಿ ಅಳೆದು ತೋರಿಸುತ್ತದೆ. ಇದನ್ನು ಅವಲಂಬಿಸಿ ತೆರಿಗೆ ವಿಧಿಸುತ್ತಾರೆ. ಪ್ರೂಫ್ ಸ್ಪಿರಿಟ್ಟಿನಲ್ಲಿ ಗಾತ್ರಾನುಸಾರ ೫೭.೧% ಆಲ್ಕೊಹಾಲಿರುತ್ತದೆ. ಅದರ ಸಾಪೇಕ್ಷ ಸಾಂದ್ರತೆ ೬೦೦ ಫ್ಯಾ.ನಲ್ಲಿ ೦.೯೧೯೭೬. ಆಲ್ಕೊಹಾಲಿನ ಪ್ರಬಲತೆಯನ್ನು ಇಂತಿಷ್ಟು ಡಿಗ್ರಿ ಅಂಡರ್ ಅಥವಾ ಓವರ್ ಪ್ರೂಫ್ ಎಂದು ನಮೂದಿಸುತ್ತಾರೆ. ೧೦% ಓವರ್ ಪ್ರೂಫ್ ಎಂದರೆ ೧೦೦ ಘ.ಸೆಂ.ಮೀ. ಆಲ್ಕೊಹಾಲ್ ೧೧೦ ಘ.ಸೆಂ.ಮೀ. ಪ್ರೂಫ್ ಸ್ಪಿರಿಟ್ಟಿಗೆ ಸಮನೆಂದೂ, ೧೦% ಅಂಡರ್ ಪ್ರೂಫ್ ಎಂದರೆ ೯೦ ಘ.ಸೆಂ.ಮೀ. ಪ್ರೂಫ್ ಸ್ಪಿರಿಟ್ಟಿಗೆ ಸಮನೆಂದೂ ತಾತ್ಪರ್ಯ. ಆಲ್ಕೊಹಾಲಿನ ಪ್ರಬಲತೆಯನ್ನು ನಿರ್ಣಯಿಸುವ ಕ್ರಮಕ್ಕೆ ಆಲ್ಕೊಹಾಲೊಮೆಟ್ರಿ ಎಂದು ಹೆಸರು.
ಸಾಮಾನ್ಯ ಗುಣಗಳು: ಮಿಥೆನಾಲಿನಂತೆ ನಿರ್ವರ್ಣವಾದ, ದಾಹಕ ರುಚಿಯುಳ್ಳ, ಸುಲಭವಾಗಿ ಆವಿಯಾಗುವ ದ್ರವ. ನೀರಿಗಿಂತ ಹಗುರ (ಸಾಪೇಕ್ಷ ಸಾಂದ್ರತೆ ೦.೭೮೯). ಅದರೊಡನೆ ಎಲ್ಲ ಪ್ರಮಾಣದಲ್ಲೂ ಬೆರೆಯುವುದು. ಆಗ ಉಷ್ಣ ನಿರ್ಗಮಿಸಿ ಗಾತ್ರ ಕುಗ್ಗುವುದು. - ೧೧೪೦ ಸೆಂ. ಗ್ರೇಡಿನಲ್ಲಿ ಘನೀಭವಿಸುವುದು. ಆದ್ದರಿಂದ ಅತಿಶೈತ್ಯವನ್ನು ಅಳೆಯುವ ಉಷ್ಣಮಾಪಕಗಳಲ್ಲಿ ಬಳಸುವರು. ಸಾವಯವ ವಸ್ತುಗಳಿಗೆ ಉತ್ತಮ ದ್ರಾವಕವಾದ್ದರಿಂದ ಔಷಧ ಕೈಗಾರಿಕೆಯಲ್ಲಿ ಇದಿಲ್ಲದೆ ಕೆಲಸ ಸಾಗದು. ಹೊತ್ತಿಸಿದರೆ ತಿಳಿನೀಲಿ ಜ್ವಾಲೆಯಿಂದ ಉರಿಯುತ್ತದೆ.
ಉಪಯೋಗಗಳು: ಇದರಿಂದ ಈಥರ್, ಎಥಲೀನ್, ಕ್ಲೋರೊಫಾರಂ, ಅಸಿಟಿಕ್ ಆಮ್ಲ ಇತ್ಯಾದಿಗಳನ್ನು ತಯಾರಿಸಬಹುದು. ಮೇಲ್ಕಂಡ ಪ್ರತಿಯೊಂದು ವಸ್ತುವಿಗೂ ವಿಶಿಷ್ಟ ಉಪಯೋಗವಿದೆ. ಪಾರಕ ಸಾಬೂನುಗಳು, ಕೇಶಮಾರ್ಜಕಗಳು, ಸುಗಂಧಗಳು, ವಾರ್ನಿಷ್ ಮತ್ತು ಲ್ಯಾಕರ್ಗಳು, ಹಣ್ಣಿನಸಾರಗಳು, ಟಾನಿಕ್ಕುಗಳು ಮೊದಲಾದ ಅಸಂಖ್ಯಾತ ವಸ್ತುಗಳ ನಿರ್ಮಾಣದಲ್ಲಿ ಮತ್ತು ಶಸ್ತ್ರಚಿಕಿತ್ಸೆಯಲ್ಲಿ ಕ್ರಿಮಿನಾಶಕವಾಗಿ ೭೦% ಆಲ್ಕೊಹಾಲ್ ಉಪಯೋಗವಾಗುತ್ತಿದೆ.
ಆಲ್ಕೊಹಾಲ್ ಮತ್ತು ಆರೋಗ್ಯ: ಉತ್ತೇಜಕ ಪಾನೀಯವಾಗಿ ವಿಶ್ವಾದ್ಯಂತ ಇದರ ಆರಾಧಕರಿದ್ದಾರೆ. ವಾಸ್ತವವಾಗಿ ಅದು ಕೇಂದ್ರ ನರಮಂಡಲವನ್ನು ಕುಂಠಿತಗೊಳಿಸುತ್ತದೆ. ಉನ್ನತ ನರಕೇಂದ್ರಗಳ ಸಂಯಮವನ್ನು ತಪ್ಪಿಸುವುದರಿಂದ ತಾತ್ಕಾಲಿಕವಾಗಿ ಉಲ್ಲಸಿತ ಭಾವನೆಯುಂಟಾಗುತ್ತದೆ. ಸಾಕಷ್ಟು ಆಲ್ಕೊಹಾಲ್ ಕುಡಿದರೆ, ಹೃದಯದ ಬಡಿತ ಮತ್ತು ರಕ್ತದ ಒತ್ತಡ ಹೆಚ್ಚುತ್ತದೆ. ಚೇತೋಹಾರಿಯಾಗಿ ಬ್ರಾಂದಿಯನ್ನು ಕುಡಿಸುವುದು ಈ ಕಾರಣದಿಂದಲೇ. ಊಟಕ್ಕೆ ಮುಂಚೆ ಆಲ್ಕೊಹಾಲ್ ಕುಡಿದರೆ ಜಠರರಸದ ಉತ್ಪನ್ನ ಹೆಚ್ಚಿಸಿ ಆಹಾರ ಪಚನಕ್ಕೆ ನೆರವಾಗುತ್ತದೆ. ಬೇಗ ರಕ್ತಗತವಾಗಿ ಟಿಷ್ಯೂಗಳಲ್ಲಿ ಉತ್ಕರ್ಷಿತವಾಗುವುದರಿಂದ ಅದಕ್ಕೆ ಶಕ್ತಿ ಒದಗಿಸುವ ಆಹಾರದ ಗುಣವಿದೆ ಎನ್ನಬಹುದು. ದೇಹಶಕ್ತಿ ಒದಗಿಸುವುದರಲ್ಲಿ ೭೮ ಗ್ರಾಂ ಕೊಬ್ಬಿಗೆ ೧೦೦ ಗ್ರಾಂ ಆಲ್ಕೊಹಾಲ್ ಸಮ. ಆದರೆ ಜಠರ ಮತ್ತು ಕರುಳಿನಲ್ಲಿ ಗ್ಲೂಕೋಸ್, ಅಮೈನೊ ಆಮ್ಲಗಳು ಮತ್ತು ಪಚನವಾದ ಕೊಬ್ಬುಗಳು ರಕ್ತಗತವಾಗುವುದಕ್ಕೆ ಇದು ಅಡ್ಡಿಯಾಗುತ್ತದೆ. ಆಲ್ಕೊಹಾಲಿನ ದೀರ್ಘ ಉಪಯೋಗದಿಂದ ಜಠರದ ಹುಣ್ಣು ಮತ್ತು ಇತರ ರೋಗಗಳಿಗೆ ದಾರಿ ಮಾಡಿಕೊಟ್ಟಂತಾಗುತ್ತದೆ. ಯಾವ ಒಂದು ರೋಗಕ್ಕೂ ಅದು ಮದ್ದಲ್ಲ.
ಇತರ ಮಾನೊಹೈಡ್ರಿಕ್ ಆಲ್ಕೊಹಾಲ್ಗಳು
[ಬದಲಾಯಿಸಿ]೧. ಪ್ರೋಪೈಲ್ ಆಲ್ಕೊಹಾಲ್ಗಳು: ಇದರಲ್ಲಿ ಎರಡು ವಿಧ. ನಾರ್ಮಲ್ ಪ್ರೋಪೈಲ್ ಆಲ್ಕೊಹಾಲನ್ನು ಫ್ಯೂಸಲ್ ಆಯಿಲ್ನಿಂದ ಮಾಡಿಕೊಳ್ಳಬಹುದು. ಅಸಿಟೋನನ್ನು ಸೋಡಿಯಂ ಅಮಾಲ್ಗಂನಿಂದ ಅಪಕರ್ಷಿಸಿದರೆ ಐಸೊಪ್ರೊಪೈಲ್ ಆಲ್ಕೊಹಾಲ್ ಬರುತ್ತದೆ. ಎರಡೂ ವಿಷವಸ್ತುಗಳು. ಮೋಟಾರ್ ವಾಹನದ ರೇಡಿಯೇಟರಿನಲ್ಲಿರುವ ನೀರು ಹೆಪ್ಪುಗಟ್ಟಿದಂತೆ ತಡೆಯಬಲ್ಲವು. ಇವುಗಳ ಅಣುಸೂತ್ರ ಮತ್ತು ರಚನೆ ಕೆಳಕಂಡಂತಿವೆ.
CH3-CH2-CH2OH (ನಾರ್ಮಲ್ ಪ್ರೋಪೈಲ್ ಆಲ್ಕೊಹಾಲ್) (ಐಸೊಪ್ರೋಪೈಲ್ ಆಲ್ಕೊಹಾಲ್)
(ಐಸೊಪ್ರೋಪೈಲ್ ಆಲ್ಕೊಹಾಲ್)
೨. ಬ್ಯೂಟೈಲ್ ಆಲ್ಕೊಹಾಲ್ಗಳು: ಇದರಲ್ಲಿ ನಾಲ್ಕು ವಿಧಗಳಿವೆ. ನಾರ್ಮಲ್ ಬ್ಯುಟಿನಾಲ್ ಅನೇಕ ಪ್ಲಾಸ್ಟಿಕ್ ಮತ್ತು ಅಂಟುಗಳಿಗೆ ಉತ್ತಮ ದ್ರಾವಕ. ಇದರ ಅಣುಸೂತ್ರ (CH3.CH2.CH2.CH2.OH). ಪಿಷ್ಟ ಪದಾರ್ಥಗಳು ವಿಶಿಷ್ಟ ಬ್ಯಾಕ್ಟೀರಿಯಾದ ಸಂಪರ್ಕದಲ್ಲಿ ಫರ್ಮೆಂಟಾದಾಗ ಇದು ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಬೇಗ ಒಣಗುವ ನೈಟ್ರೋ ಸೆಲ್ಯುಲೋಸ್ ಪೆಯಿಂಟುಗಳು ಮತ್ತು ಲ್ಯಾಕರುಗಳಿಗೆ ಇದು ಲೀನಕಾರಿಯಾಗಿದೆ. ಬ್ಯೂಟೈಲ್ ಅಸಿಟೇಟ್ ಒಂದು ಹಣ್ಣಿನ ಸಾರ. ಐಸೊಬ್ಯೂಟೈಲ್ ಆಲ್ಕೊಹಾಲನ್ನು ಫಿಷರ್-ಟ್ರೋಷ್ ವಿಧಾನದಿಂದ ನಿಕ್ಕಲ್ ಕ್ಯಾಟಲಿಸ್ಟ್ (ವೇಗವರ್ಧಕ) ಬಳಸಿ ಮಾಡಿಕೊಳ್ಳಬಹುದು.
CH3
4CO + 8H2 → CH-CH2OH + 3H2O
CH3
ಐಸೊಬ್ಯೂಟೈಲ್ ಆಲ್ಕೊಹಾಲ್
ಐಸೊಬ್ಯೂಟೈಲ್ ಆಲ್ಕೊಹಾಲಿನಿಂದ ಕೃತಕ ಕಸ್ತೂರಿಯನ್ನು ಮಾಡುತ್ತಾರೆ. ಸೆಕೆಂಡರಿ ಬ್ಯೂಟೇನಾಲ್ ( ) ಸಹ ಉತ್ತಮ ದ್ರಾವಕ. ಇದರಿಂದ ಹೈಡ್ರೊಜನ್ನಿನ ಒಂದಂಶವನ್ನು ತೆಗೆದು ಹಾಕಿದರೆ ಉತ್ತಮ ದ್ರಾವಕವಾದ ಮೀಥೈಲ್ ಈಥೈಲ್ ಕೀಟೋನ್ ಲಭಿಸುತ್ತದೆ. ಟರ್ಷಿಯರಿ ಬ್ಯೂಟೆನಾಲನ್ನು ಸಹ ದ್ರಾವಕವಾಗಿ (ಸಾಲ್ವೆಂಟ್) ಬಳಸಲಾಗುತ್ತಿದೆ.
) ಸಹ ಉತ್ತಮ ದ್ರಾವಕ. ಇದರಿಂದ ಹೈಡ್ರೊಜನ್ನಿನ ಒಂದಂಶವನ್ನು ತೆಗೆದು ಹಾಕಿದರೆ ಉತ್ತಮ ದ್ರಾವಕವಾದ ಮೀಥೈಲ್ ಈಥೈಲ್ ಕೀಟೋನ್ ಲಭಿಸುತ್ತದೆ. ಟರ್ಷಿಯರಿ ಬ್ಯೂಟೆನಾಲನ್ನು ಸಹ ದ್ರಾವಕವಾಗಿ (ಸಾಲ್ವೆಂಟ್) ಬಳಸಲಾಗುತ್ತಿದೆ.
೩. ಅಮೈಲ್ ಆಲ್ಕೊಹಾಲ್ಗಳು: ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳ ಜೋಡಣೆಗೆ ಅನುಗುಣವಾಗಿ ಎಂಟು ವಿಧವಾದ ಅಮೈಲ್ ಆಲ್ಕೊಹಾಲುಗಳಿವೆ. ಇವುಗಳ ಅಣುಸೂತ್ರ (C5H11OH). ಅವುಗಳ ಪೈಕಿ ಎರಡು ಫ್ಯೂಸೆಲ್ ಆಯಿಲ್ನಲ್ಲಿದೆ. ಅಮೈಲ್ ಅಸಿಟೇಟ್ ಇದರ ಎಸ್ಟರು. ದ್ರಾವಕ ಮತ್ತು ಹಣ್ಣಿನ ಸಾರವಾಗಿ ಅದಕ್ಕೆ ಮಹತ್ತ್ವವಿದೆ.
ಉಲ್ಲೇಖಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Alcohols". doi:10.1351/goldbook.A00204
- ↑ Saul Patai, ed. (1971). The Hydroxyl Group. PATAI'S Chemistry of Functional Groups. doi:10.1002/9780470771259. ISBN 9780470771259.
- ↑ William Reusch. "Alcohols". VirtualText of Organic Chemistry. Archived from the original on 19 September 2007. Retrieved 14 September 2007.
ಗ್ರಂಥಗಳು
[ಬದಲಾಯಿಸಿ]- Metcalf, Allan A. (1999). The World in So Many Words. Houghton Mifflin. ISBN 0-395-95920-9.

- Dead-end pages from ಜುಲೈ ೨೦೧೭
- Articles with invalid date parameter in template
- All dead-end pages
- Articles covered by WikiProject Wikify from ಜುಲೈ ೨೦೧೭
- All articles covered by WikiProject Wikify
- ವಿಕಿಪೀಡಿಯ ನಿರ್ವಹಣೆ
- ರಸಾಯನಶಾಸ್ತ್ರ
- ವಿಜ್ಞಾನ ಸಾಹಿತ್ಯ
- ಮೈಸೂರು ವಿಶ್ವವಿದ್ಯಾನಿಲಯ ವಿಶ್ವಕೋಶ
- Pages that use a deprecated format of the chem tags

![{\displaystyle {\ce {CH2=CH2 ->[H2SO4][] CH3-CH2-HSO4 ->[H2O] CH3-CH2-OH + H2SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f5478b3ad87d9244a27e221baaf9b869be739ef)
![{\displaystyle {\ce {CH3-CH=CH-CHO ->[LiAlH_4 or][((CH_3)_2CHO)_3Al] CH3-CH=CH-CH2OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/99315a5736a37a0b5c3a760a36eb7973dcf64276)
![{\displaystyle {\ce {CH3-CO-CH3 ->[H_2][Ni] CH3-CH(OH)-CH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1856017d42c1b50780ee879cad80e6fb5eaa4ef2)
![{\displaystyle {\ce {C11H23.COOH ->[C_2H_5OH] C11H23.COOC2H5 + H2 ->[200^0 C 200 a.p.][CuCr_2O_4] C11H23.CH2OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/77aa0d3d2c5a4b65a7ea9a20c82304b55c9d5f61)
![{\displaystyle {\ce {R.CO.Cl ->[2H_2] R.CH2OH + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0f7b235918321ef4774333aa259f5699c9c7f9be)
![{\displaystyle {\ce {->[2H_2]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cb882f7320e3571f86c041090b971e341cac1a42)
![{\displaystyle {\ce {C15H31COOC31H63 ->[H_2O] C15H31COOH + C31H63OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f918a641c79690ef33535d0019eea999b45a88d2)

![{\displaystyle {\ce {ROH + HCl ->[dry][ZnCl_2] RCl + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c36e311fb22d16d00fcb8fe2c059951cb5a4d2a0)


![{\displaystyle {\ce {->[2NaOH + I_2] R-CO-CH3 + 2NaI + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/953a6da08c580ee8e9507625e1ba4d36514bea16)
![{\displaystyle {\ce {R.COONa + CHI3 <-[NaOH] R.CO.CI3 + 3NaI + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e8d5711454aa344a2a4c05d1fc9dadd3d6d303aa)
![{\displaystyle {\ce {CH3OH->[\lbrack O\rbrack ]HCHO->[\lbrack O\rbrack ]HCOOH->[\lbrack O\rbrack ]CO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e9d04cf691838a23618475b232c5882201dc6c15)
![{\displaystyle {\ce {CH#CH ->[H_2O] CH3CHO ->[H_2] CH3CH2OH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a110e0f9f768684afd6d4b909258b463304de6fd)