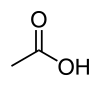
ಅಸಿಟಿಕ್ ಆಮ್ಲ
| |||
| |||

| |||
| ಹೆಸರುಗಳು | |||
|---|---|---|---|
| ಐಯುಪಿಎಸಿ ಹೆಸರು | |||
| Other names | |||
| Identifiers | |||
| ECHA InfoCard | 100.000.528 | ||
| E number | E260 (preservatives) | ||
| ಗುಣಗಳು | |||
| ಆಣ್ವಿಕ ಸೂತ್ರ | C2H4O2 | ||
| ಮೋಲಾರ್ ದ್ರವ್ಯರಾಶಿ | ೬೦.೦೫ g mol−1 | ||
| ಸಾಂದ್ರತೆ | 1.049 g cm−3 | ||
| ಕರಗು ಬಿಂದು |
-274 °C, 289 - 290 K, -461 °F | ||
| ಕುದಿ ಬಿಂದು |
-274 °C, 391 - 392 K, -461 °F | ||
| ಕರಗುವಿಕೆ ನೀರಿನಲ್ಲಿ | Miscible | ||
| log P | -0.322 | ||
| ಅಮ್ಲತೆ (pKa) | 4.76[೫] | ||
| ಪ್ರತ್ಯಾಮ್ಲತೆ (pKb) | 9.24 (basicity of acetate ion) | ||
| ವಕ್ರೀಕಾರಕ ಸೂಚಿ (nD) (ರಿಫ್ರಾಕ್ಟಿವ್ ಇಂಡೆಕ್ಸ್) | 1.371 | ||
| ಸ್ನಿಗ್ಧತೆ (ವಿಸ್ಕಾಸಿಟಿ) | 1.22 mPa s | ||
| ದ್ವಿಧ್ರುವ ಚಲನೆ | 1.74 D | ||
| Hazards | |||
| ಚಿಮ್ಮು ಬಿಂದು (ಫ್ಲಾಶ್ ಪಾಯಿಂಟ್) |
|||
| 427 °C (801 °F; 700 K) | |||
| Lethal dose or concentration (LD, LC): | |||
LD50 (median dose)
|
3.31 g kg−1, oral (rat) | ||
LC50 (median concentration)
|
5620 ppm (mouse, 1 hr) 16000 ppm (rat, 4 hr)[೭] | ||
| US health exposure limits (NIOSH): | |||
REL (Recommended)
|
TWA 10 ppm (25 mg/m3) ST 15 ppm (37 mg/m3)[೬] | ||
IDLH (Immediate danger)
|
50 ppm[೬] | ||
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). > | |||
| Infobox references | |||

ಅಸಿಟಿಕ್ ಆಮ್ಲ ಒಂದು ಕಾರ್ಬನಿಕ್ ರಸಾಯನ. ಇದರ ರಚನಾ ಸೂತ್ರ (Structural Formula) CH3COOH. ಇದನ್ನು ಇಥನೊಯಿಕ್ ಆಮ್ಲವೆಂದು ಕರೆಯಬಹುದು, ಫ್ಯಾಟಿ ಆಮ್ಲಗಳ ಗುಂಪಿಗೆ ಸೇರಿದೆ. ಶುದ್ಧ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಬಣ್ಣವಿಲ್ಲದ ದ್ರವವಾಗಿದ್ದು ೧೬.೭ ಡಿಗ್ರಿ ಸೆಂಟಿಗ್ರೇಡ್ ಉಷ್ಣಾಂಶದಲ್ಲಿ ಆವಿಯಾಗುತ್ತದೆ. ಇದನ್ನು ಮುಖ್ಯವಾಗಿ ಎಸ್ಟರ್ ಎಂಬ ದ್ರಾವಣಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಬಳಸುತ್ತಾರೆ. ವಿನಗರ್ನ ತಯಾರಿಕೆಯಲ್ಲಿಯೂ ಬಳಕೆಯಾಗುತ್ತದೆ. ಇದು ವಿನಗರ್ಗೆ ಹುಳಿ ರುಚಿಯನ್ನು ಕೊಡುತ್ತದೆ. ಇದಕ್ಕೆ ತೀಕ್ಷ್ಣವಾದ ಕಿರಿಕಿರಿ ಉಂಟುಮಾಡುವ ವಾಸನೆ ಇದೆ. ಇದು ನೀರಿನೊಂದಿಗೆ ಸುಲಭವಾಗಿ ಬೆರೆಯುತ್ತದೆ.
ದ್ರಾಕ್ಷಿ ಸೇಬು ಮುಂತಾದ ಹಣ್ಣುಗಳ ರಸ ಗಾಳಿಗೆ ಬಿಟ್ಟಂತೆಲ್ಲ ಕ್ರಮೇಣ ಹೆಚ್ಚು ಹೆಚ್ಚಾಗಿ ಹುಳಿ ಹಿಡಿಯುವುದಕ್ಕೆ ಕಾರಣ ಈ ಅಸಿಟಿಕ್ ಆಮ್ಲದ ವರ್ಧನೆ. ದ್ರಾಕ್ಷಾರಸದಲ್ಲಿನ ಮದ್ಯಸಾರ ಗಾಳಿಯಲ್ಲಿನ ಆಕ್ಷಿಜನ್ನಿಂದ ಉತ್ಕರ್ಷಣ ಹೊಂದಿ ಅಂತಿಮವಾಗಿ ಅಸಿಟಿಕ್ ಆಮ್ಲವುಂಟಾಗಲು ಕಾರಣವಾಗುತ್ತದೆ. ಈ ಉತ್ಕರ್ಷಣಕ್ರಿಯೆಯಲ್ಲಿ ಅನೇಕ ಏಕಾಣು ಜೀವಿಗಳು ಬಹಳ ಉತ್ತೇಜನಕಾರಿಗಳು. ಪ್ರಾಯಶಃ ಮದ್ಯಸಾರ ಮೊದಲು ಉತ್ಕರ್ಷಣ ಕ್ರಿಯೆಯಿಂದ ಅಸಿಟಾಲ್ಡಿಹೈಡ್ ಆಗಿ, ಅಂತಿಮವಾಗಿ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಆಗುವುದು.
ಇತಿಹಾಸ
[ಬದಲಾಯಿಸಿ]ಈ ಆಮ್ಲ ಪೂರ್ವಿಕರಿಗೆ ಗೊತ್ತಿತ್ತು. ಹಿಂದೆ ರೋಮ್ ನಗರದಲ್ಲಿ ಮುತ್ತುಗಳನ್ನು ವಿನೆಗರ್ನಲ್ಲಿ (ದುರ್ಬಲ ಅಸಿಟಿಕ್ ಆಮ್ಲ) ವಿಲೀನಗೊಳಿಸಿ ಅದನ್ನು ಸೇವಿಸಿ ಕ್ಲಿಯೋಪಾತ್ರ ಸಂತೋಷಪಡುತ್ತಿದ್ದಳೆಂದು ಪ್ಲಿನಿ ಬರೆವಣಿಗೆಯಿಂದ ತಿಳಿದುಬರುವುದು. ಕೆಟ್ಟು ಹೋದ ದ್ರಾಕ್ಷಾರಸದ ಉತ್ಕರ್ಷಣದಿಂದ ಈ ಆಮ್ಲವನ್ನು ಪಡೆಯುವುದು ಅವರಿಗೆ ಗೊತ್ತಿತ್ತು. ದ್ರಾಕ್ಷಾರಸದ ಉತ್ಕರ್ಷಣದಿಂದ ಉಂಟಾದ ಆಮ್ಲ ದುರ್ಬಲವಾಗಿಯೂ ಲವಣಗಳಿಂದ ಕೂಡಿರುವ ಕೆಂಪು ದ್ರವವಾಗಿಯೂ ಇರುತ್ತಿತ್ತು. ಈ ಅಶುದ್ಧ ಆಮ್ಲವನ್ನು ವಿನೆಗರ್ ಎಂದು ಕರೆಯುತ್ತಿದ್ದರು. ವಿನೆಗರ್ನಲ್ಲಿ ೬%-೧೦% ಅಸಿಟಿಕ್ ಆಮ್ಲವಿರುವುದು.
ಈ ಆಮ್ಲ ಹಾಗೆಯೇ n--ಹೆಕ್ಸೈಲ್ ಮತ್ತು n--ಆಕ್ಟೈಲ್ ಆಲ್ಕೋಹಾಲುಗಳು ಎಸ್ಟರ್ ರೂಪದಲ್ಲಿ ಹೆರಾಕ್ಲಿಯಮ್ ಜೈಗಾಂಟಿಯಮ್ ಮತ್ತು ಹೆರಾಕ್ಲಿಯಮ್ ಸ್ಟೊಂಡೈಲಿಯಮ್ ಗಿಡಗಳ ಬೀಜ ಮತ್ತು ಹಣ್ಣುಗಳಲ್ಲಿ ಕ್ರಮವಾಗಿ ಇರುವುದೆಂದು ತಿಳಿದುಬಂದಿದೆ. ಬೆವರಿನಲ್ಲಿಯೂ ಲೇಶ ಇದೆ. ೧೮ನೆಯ ಶತಮಾನದ ಅಂತ್ಯದಲ್ಲಿ ಎ. ಎಲ್. ಲೆನಾಯಿಸಿಯರ್ ಆಲ್ಕೋಹಾಲಿನಿಂದ ವಿನೆಗರ್ಅನ್ನು ತಯಾರಿಸುವುದಕ್ಕೆ ಗಾಳಿ ಅತ್ಯವಶ್ಯವೆಂದು ತೋರಿಸಿದ. ಜೆ. ಬಿ. ಎ. ಡ್ಯೂಮಾಸ್ ಎಂಬಾತ ೧೮೩೦ರಲ್ಲಿ ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ಟ್ರೈಕ್ಲೋರೊ ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನಾಗಿ ಪರಿವರ್ತಿಸಿದ. ಮೆಲ್ಸೆನ್ಸ್ ಎಂಬ ಮತ್ತೊಬ್ಬ ವಿಜ್ಞಾನಿ ಟ್ರೈಕ್ಲೋರೊ ಅಸಿಟಿಕ್ಆಮ್ಲವನ್ನು ಸೋಡಿಯಂ ಅಮಾಲ್ಗಮ್ನಿಂದ ಅಪಕರ್ಷಿಸಿ ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ಪಡೆದ (೧೮೪೨). ಎಚ್. ಕೋಲ್ಬೆ ಎಂಬಾತ ಮೂಲವಸ್ತುಗಳಿಂದ ಟ್ರೈಕ್ಲೋರೊ ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ತಯಾರಿಸಿ ಅಸಿಟಿಕ್ ಆಮ್ಲದ ಅಣುರಚನೆಯನ್ನು ಸಿದ್ಧಪಡಿಸುವುದಕ್ಕೆ ನೆರವಾದ (೧೮೪೩). ವಿಧ್ವಂಸಕ ಭಟ್ಟಿ ಇಳಿಸುವ ಕ್ರಮದಿಂದ (ಡಿಸ್ಟ್ರಕ್ಟಿವ್ ಡಿಸ್ಟಿಲ್ಲೇಷನ್) ಕಟ್ಟಿಗೆ ಹಲವಾರು ಸಂಯುಕ್ತಗಳನ್ನು ಕೊಡುವುದೆಂದು ಹಿಂದಿನವರು ಗಮನಿಸಿದ್ದರು (೧೬೬೧). ಬಾಯಿಲ್ನು ಅವುಗಳಲ್ಲಿರುವ ಒಂದು ದಹ್ಯವಸ್ತುವನ್ನು ಕಂಡುಹಿಡಿದು ಅದಕ್ಕೆ ವುಡ್ಸ್ಪಿರಿಟ್ ಎಂದು ಹೆಸರಿಟ್ಟ. ಜರ್ಮನ್ ವಿಜ್ಞಾನಿ ಗ್ಲಾಬರ್, ಉತ್ಪತ್ತಿಯಾದ ಇಂಗಾಲದ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ವಿನೆಗರ್ ಎಂಬ ಸಂಯುಕ್ತ ಮುಖ್ಯವಾದುದು ಎಂದು ತೋರಿಸಿದ (೧೬೫೮). ಟೈಲರ್ ವುಡ್ಸ್ಪಿರಿಟ್ ಆಲ್ಕೋಹಾಲೆಂದೂ (೧೮೩೪) ಗುರುತಿಸಿದರು. ಕೋಲ್ಟಾರ್ ಎಣ್ಣೆಯ ಸಂಯುಕ್ತಗಳು ಬಳಕೆಗೆ ಬಂದಮೇಲೆ, ಕಟ್ಟಿಗೆಯ ವಿಧ್ವಂಸಕ ಬಟ್ಟಿಯಿಂದ ಬರುವ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಅಸಿಟಿಕ್ ಆಮ್ಲ, ಮೀಥೈಲ್ ಆಲ್ಕೋಹಾಲ್ ಮತ್ತು ಅಸಿಟೋನ್ ಈ ಮೂರು ಸಂಯುಕ್ತಗಳು ಬಹಳ ಮುಖ್ಯ.[೮]
ಅಸಿಟಿಕ್ ಆಮ್ಲದ ತಯಾರಿಕೆ
[ಬದಲಾಯಿಸಿ]ಹಣ್ಣಿನ ರಸಗಳನ್ನು ಹುದುಗುವಂತೆ ಮಾಡಿ ಹುಳಿಹಿಡಿಸಿ, ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ತಯಾರಿಸಿದ್ದು ಮೊದಲಕೈಗಾರಿಕಾ ವಿಧಾನವೆನ್ನಬಹುದು. ಈ ವಿಧಾನದಲ್ಲಿ ಉತ್ಪಾದಿತವಾಗುವ ಆಮ್ಲದ ಪರಮಾಧಿ ಶೇಕಡಾಂಶ ೫. ಕಚ್ಚಾ ಹಣ್ಣಿನ ಬದಲು ದುರ್ಬಲ ಆಲ್ಕೋಹಾಲ್ ಉಪಯೋಗಿಸಿ ಆಮ್ಲದ ಶೇಕಡಾಂಶವನ್ನು ೧೨-೧೪ ರವರೆಗೆ ಏರಿಸಬಹುದು.
ವಿಧಾನ ೧: ೨೫೦-೪೦೦ ಸೆಂ. ಅಂತರದಲ್ಲಿ ತಾಂಡವಾಳದ ಪಾತ್ರೆಗಳಲ್ಲಿ ಕಟ್ಟಿಗೆಗಳನ್ನು ಇಟ್ಟು ಗಾಳಿಯ ಸಂಪರ್ಕವಿಲ್ಲದೆ ಕಾಯಿಸಿದಾಗ ನಾಲ್ಕು ಬಗೆಯ ವಸ್ತುಗಳು ಬರುವುವು. ೧ ವುಡ್ಗ್ಯಾಸ್; ೨ ನೀರು ಮಿಶ್ರದ್ರವ (ಪೈರೋಲಿಗ್ನಿಯಸ್ ಆಮ್ಲ);೩ ವುಡ್ಟಾರು; ಮತ್ತು ೪ ವುಡ್ಶೇಷ. ಇವುಗಳಲ್ಲಿ ಮುಖ್ಯವಾದುದು ನೀರು ಮಿಶ್ರದ್ರವವಾದ ಪೈರೊಲಿಗ್ನಿಯಸ್ ಆಮ್ಲ. ಈ ಆಮ್ಲದಲ್ಲಿ ೯%-೧೦% ರಷ್ಟು ಅಸಿಟಿಕ್ ಆಮ್ಲ, ೧%-೨% ರಷ್ಟು ಮೀಥೈಲ್ ಆಲ್ಕೋಹಾಲು ಮತ್ತು ೦.೧%-೦.೫% ರಷ್ಟು ಅಸಿಟೋನ್ ಇರುವುವು.
ಮೂರು ಪಾತ್ರೆಗಳ ಜೋಡಣೆಯಲ್ಲಿ ಪೈರೊಲಿಗ್ನಿಯಸ್ ಆಮ್ಲವನ್ನು ನೀರಾವಿಯನ್ನು ಸಿಂಬಿಯ ಮೂಲಕ ಹಾಯಿಸಿ ಕಾಯಿಸಿದಾಗ, ಆಮ್ಲದಲ್ಲಿರುವ ಅಸಿಟಿಕ್ ಆಮ್ಲ, ಮೀಥೈಲ್ ಆಲ್ಕೋಹಾಲ್ ಮತ್ತು ಅಸಿಟೋನ್ ಇವು ಆವಿಯಾಗುತ್ತವೆ. ಆವಿಯನ್ನು ಅರಳಿದ ಸುಣ್ಣ ಇರುವ ಒಂದೇ ತೆರನಾದ ಎರಡು ಪಾತ್ರೆಗಳ ಮೂಲಕ ಹಾಯಿಸುವರು. ಪೈರೊಲಿಗ್ನಿಯಸ್ ಆಮ್ಲದಲ್ಲಿರುವ ಟಾರು ಕೆಳಗೆ ಉಳಿದು ಕವಾಟದ ಮೂಲಕ ಹರಿದು ಕೆಳಗಡೆ ಇರುವ ಪಾತ್ರೆಯಲ್ಲಿ ಶೇಖರವಾಗುವುದು. ಎರಡು ಪಾತ್ರೆಗಳಲ್ಲಿರುವ ಅರಳಿದ ಸುಣ್ಣ ಅಸಿಟಿಕ್ಆಮ್ಲ ವರ್ತಿಸಿ ಆವಿಯಾಗದ ಕ್ಯಾಲ್ಸಿಯಂ ಅಸಿಟೇಟ್ ಸಂಯುಕ್ತ ಉಂಟಾಗುವುದು. ನೀರಾವಿಯನ್ನು ಈ ಎರಡು ಪಾತ್ರೆಗಳ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಅಸಿಟೋನ್ ಮತ್ತು ಮೀಥೈಲ್ ಆಲ್ಕೋಹಾಲ್ ಆವಿಯಾಗಿ ಕ್ಯಾಲ್ಸಿಯಂ ಅಸಿಟೇಟ್ ಹಾಗೆಯೇ ಉಳಿಯುವುದು. ಇದನ್ನು ಇನ್ನೆರಡು ಕವಾಟಗಳ ಮೂಲಕ ಹರಿಸಿ ಪಾತ್ರೆಯಲ್ಲಿ ಶೇಖರಿಸಿ ದೊಡ್ಡ ಬೇಸಿನ್ನಲ್ಲಿ ಸಾಂದ್ರೀಕರಿಸುವರು. ೮೦%ರಷ್ಟು ಪ್ರಬಲ ದ್ರಾವಣ ಉಂಟಾಗುವುದು. ಗಂಧಕಾಮ್ಲ ಕ್ಯಾಲ್ಸಿಯಂ ಅಸಿಟೇಟ್ನಲ್ಲಿರುವ ಆಮ್ಲವನ್ನು ಬಿಡುಗಡೆ ಮಾಡುವುದು.
CH3COO
Ca + SO4 H2 2CH3COOH + CaSO4
CH3COO
೭೦%-೭೫% ರಷ್ಟು ಅಸಿಟಿಕ್ ಆಮ್ಲ ಉಂಟಾಗುವುದು. ಶುದ್ಧ ಆಮ್ಲ ಬೇಕಾದರೆ ಉತ್ಪತ್ತಿಯಾದ ಆಮ್ಲವನ್ನು ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ ದ್ರಾವಣದಲ್ಲಿ ತಟಸ್ಥೀಕರಿಸಿ, ಸೋಡಿಯಂ ಅಸಿಟೇಟ್ ದ್ರಾವಣವನ್ನು ಸಾಂದ್ರೀಕರಿಸಿ, ಸೋಡಿಯಂ ಅಸಿಟೇಟ್ ಹರಳುಗಳನ್ನು ಪ್ರಬಲ ಗಂಧಕಾಮ್ಲದೊಡನೆ ಬಟ್ಟಿ ಇಳಿಸಿದಾಗ ಗ್ಲೇಷಿಯಲ್ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಉತ್ಪತ್ತಿಯಾಗುವುದು.
ವಿಧಾನ ೨: ೧೨%-೧೫% ರಷ್ಟು ಆಲ್ಕೋಹಾಲ್ ಇರುವ ಹುಳಿ ಹಿಡಿದ ಕಷಾಯ (ಫರ್ಮೆಂಟೆಡ್ ಲಿಕ್ಕರ್) ಬ್ಯಾಕ್ಟೀರಿಯ ಅಸಿಟೈಜೀವಾಣುಗಳ ಸಂಪರ್ಕದಲ್ಲಿ ಗಾಳಿಯೊಡನೆ ವರ್ತಿಸಿ ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ಕೊಡುವುದು.
CH3.CH2.OH + O2 → CH3.COOH + H2O.
ವಿಧಾನ ೩: ಕ್ವಿಕ್ ವಿನೆಗರ್ ವಿಧಾನದಲ್ಲಿ ಅಸಿಟಿಕ್ ಫಂಗಸ್ ಅಥವಾ ಬ್ಯಾಕ್ಟೀರಿಯಂ ಅಸಿಟೈ ಜೀವಾಣುಗಳ ಸಂಪರ್ಕದಲ್ಲಿ ದುರ್ಬಲ ಆಲ್ಕೋಹಾಲನ್ನು ತೊಟ್ಟು ತೊಟ್ಟಾಗಿ ಮರದ ಸಿಪ್ಪೆಗಳ ಮೇಲೆ ಬೀಳುವಂತೆ ಮಾಡಿ, ಗಾಳಿಯನ್ನು ಅದರ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ ಆಲ್ಕೋಹಾಲ್ ಉತ್ಕರ್ಷಣ ಹೊಂದಿ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಬರುವುದು. ಆಲ್ಕೋಹಾಲ್ ಉತ್ಕರ್ಷಣ ಹೊಂದಿದಾಗ ಉಷ್ಣತೆ ಉತ್ಪತ್ತಿಯಾಗಿ ೩೫ ಸೆಂ. ಗ್ರೇ. ಮಟ್ಟದಲ್ಲಿರುವುದು. ಜೀವಾಣುಗಳು ಬೆಳೆಯುವುದಕ್ಕೆ ಈ ಉಷ್ಣತೆ ಅತ್ಯಂತ ಅನುಕೂಲವಾಗಿರುವುದು. ದುರ್ಬಲ ದ್ರಾವಣದಲ್ಲಿ ೧೦% ರಷ್ಟು ಅಸಿಟಿಕ್ ಆಮ್ಲವಿರುವುದು. ಈ ರೀತಿ ಆಗಲು ಹತ್ತು ದಿವಸಗಳಾಗುತ್ತವೆ.
ವಿಧಾನ ೪: ಇತ್ತೀಚೆಗೆ ಆಮ್ಲವನ್ನು ಅಸಿಟಲೀನ್ನಿಂದ ತಯಾರಿಸುವರು. ಅಸಿಟಲೀನ್ ಅನಿಲವನ್ನು ಪಾದರಸದ ಸಲ್ಫೇಟ್ ಇರುವ ದುರ್ಬಲ ಗಂಧಕಾಮ್ಲದ ಮೂಲಕ ಹಾಯಿಸಿದರೆ ಅಸಿಟಾಲ್ಡಿಹೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುವುದು. ಈ ಆಲ್ಡಿಹೈಡಿನ ಆವಿಯನ್ನೂ ಗಾಳಿಯನ್ನೂ ಮಿಶ್ರಮಾಡಿ ೬೦ ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿ ಮ್ಯಾಂಗನೀಸ್ ಅಸಿಟೇಅಟಿನ ಮೇಲೆ ಹಾಯಿಸಿದಾಗ ಆಲ್ಡಿಹೈಡ್ ಉತ್ಕರ್ಷಣ ಹೊಂದಿ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಉತ್ಪತ್ತಿಯಾಗುವುದು.[೯]
CH≡CH2O → CH3.CHO
2CH3.CHO + O2 → 2CH3.COOH
ವಿಧಾನ ೫: ಮಿಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ ಇಂಗಾಲದ ಮಾನಾಕ್ಸೈಡ್ ವಿಧಾನ.
CH3OH + CO → CH3.COOH
ಮೂಲಭೂತವಾಗಿ ಪೆಟ್ರೋಲಿಯಂ ಎಣ್ಣೆಬಾವಿಗಳನ್ನು ತೋಡುವಾಗ ಚಿಮ್ಮುವ ನೈಸರ್ಗಿಕ ಅನಿಲದಿಂದ ಅಂತಿಮವಾಗಿ ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ಈ ವಿಧಾನದಿಂದ ಪಡೆಯಬಹುದು. ಒಟ್ಟಿನಲ್ಲಿ ಈ ಎಲ್ಲ ವಿಧಾನಗಳಲ್ಲೂ ಉತ್ಪನ್ನವಾಗುವ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಇತರ ಅನೇಕ ಸಾವಯವ ಸಂಯುಕ್ತಗಳು ಮತ್ತು ನೀರಿನೊಡನೆ ಬೆರೆತೇ ದೊರೆಯುವುದು. ನಿಯಂತ್ರಿತ ರೀತಿಯಲ್ಲಿ ಭಟ್ಟಿ ಇಳಿಸುವುದರ ಮೂಲಕ ಶುದ್ಧ ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ಬೇರ್ಪಡಿಸಬೇಕು. ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ಉಪಯೋಗಿಸುವ ಕೈಗಾರಿಕೆಗಳಲ್ಲಿ ಉಪಯೋಗದ ಅನಂತರ ದುರ್ಬಲ ಅಸಿಟಿಕ್ ಆಮ್ಲ ದ್ರಾವಣ ಗಣನೀಯ ಪ್ರಮಾಣದಲ್ಲಿ ಶೇಖರಿತವಾಗುವುದು. ಅದನ್ನು ಸೂಕ್ತ ರೀತಿಯಲ್ಲಿ ಭಟ್ಟಿ ಇಳಿಸುವುದರಿಂದಾಗಲಿ ಅಥವಾ ಲೀನಕಾರಿಗಳಲ್ಲಿ ಮಿಲನವಾಗುವಂತೆ ಮಾಡಿ ಅನಂತರ ಮತ್ತೆ ಭಟ್ಟಿ ಇಳಿಸುವುದರಿಂದಾಗಲಿ ಸಾರೀಕರಣ ಮಾಡಿ ಮತ್ತೆ ಉಪಯೋಗಿಸುವರು.
ಗುಣಗಳು
[ಬದಲಾಯಿಸಿ]೧೬.೬೦ ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿ ಕರಗುವ, ೧೧೮೦ ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿ ಕುದಿಯುವ ಅನ್ಹೈಡ್ರಸ್ ಆಮ್ಲವನ್ನು ಗ್ಲೇಷಿಯಲ್ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಎನ್ನುವರು. ಪಾಶ್ವಿಮಾತ್ಯ ದೇಶಗಳಲ್ಲಿ ಚಳಿಗಾಲ ಬಂದಾಗ ಪ್ರಯೋಗ ಶಾಲೆಗಳಲ್ಲಿ ಈ ಆಮ್ಲ ಮಂಜುಗಡ್ಡೆಯಂಥ ಹರಳಾಕೃತಿಯನ್ನು ಹೊಂದಿರುವ ಕಾರಣ ಗ್ಲೇಷಿಯಲ್ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಎಂದು ಹೆಸರುಂಟಾಯಿತು.[೧೦] ಈ ಆಮ್ಲದಲ್ಲಿ ತೇವಾಂಶವಿದ್ದರೆ ಅದರ ಕುದಿಯುವ ಬಿಂದು ಕಡಿಮೆಯಾಗುವುದು. ಇದು ಜಲಾಕರ್ಷಕ. ಈಥರ್, ಆಲ್ಕೋಹಾಲ್ ಮತ್ತು ನೀರು ಇವುಗಳಲ್ಲಿ ಎಲ್ಲ ಪ್ರಮಾಣಗಳಲ್ಲಿ ಬೆರೆಯುವುದು. ಇದು ನೀರಿನಲ್ಲಿ ವಿಲೀನವಾದಾಗ ಉಷ್ಣತೆ ಉತ್ಪತ್ತಿಯಾಗಿ, ಗಾತ್ರದಲ್ಲಿ ಕುಗ್ಗಿ ಮತ್ತೆ ಹಿಗ್ಗುವುದು. ಈ ಆಮ್ಲ ಗಂಧಕ, ಅಯೋಡಿನ್ ರಂಜಕ ಮತ್ತು ಇಂಗಾಲದ ಸಂಯುಕ್ತಗಳನ್ನು ವಿಲೀನಗೊಳಿಸುವುದು. ಇದು ಚರ್ಮದ ಮೇಲೆ ಬಿದ್ದಾಗ ತೀವ್ರ ನೋವುಂಟುಮಾಡುವ ಗಾಯಗಳಾಗುತ್ತವೆ.[೧೧][೧೨] ಇದು ಏಕಪ್ರತ್ಯಾಮ್ಲೀಯ ಆಮ್ಲ. ಅಯೋಡಿನ್ ಸಂಪರ್ಕದಲ್ಲಿ ಕ್ಲೋರಿನ್ ಅಸಿಟಿಕ್ ಆಮ್ಲದೊಡನೆ ವರ್ತಿಸಿದಾಗ ಕ್ಲೋರೋ ಅಸಿಟಿಕ್ಆಮ್ಲಗಳು ಉಂಟಾಗುವುವು. ಕ್ಷಾರ, ಆಕ್ಸೈಡ್ ಮತ್ತು ಕಾರ್ಬೊನೇಟ್ ಇವುಗಳೊಡನೆ ವರ್ತಿಸಿ ಅಸಿಟೇಟ್ ಲವಣಗಳನ್ನು ಕೊಡುವುದು. ಆಲ್ಕೋಹಾಲಿಗೆ ಸ್ವಲ್ಪ ದುರ್ಬಲ ಗಂಧಕಾಮ್ಲವನ್ನು ಸೇರಿಸಿ ಅಸಿಟಿಕ್ ಆಮ್ಲದೊಡನೆ ಕಾಯಿಸಿದಾಗ ಸುವಾಸನೆಯುಳ್ಳ ಎಸ್ಟರ್ ಉತ್ಪತ್ತಿಯಾಗುವುದು.
ಆರ್ಸೆನಿಕ್ ಆಕ್ಸೈಡಿನೊಡನೆ ಇದನ್ನು ಕಾಯಿಸುವುದರಿಂದ ಘಾಟುವಾಸನೆಯುಳ್ಳ ವಿಷ ಸಂಯುಕ್ತ ಕ್ಯಾಕೊಡಿಲ್ ಆಕ್ಸೈಡ್ ಉಂಟಾಗುವುದು. ಅಸಿಟಿಕ್ ಆಮ್ಲದ ಆವಿಯನ್ನು ಮ್ಯಾಂಗನೀಸ್ ಆಕ್ಸೈಡಿನ ಮೇಲೆ ೩೦೦ ಸೆಂ.ಗ್ರೇ. ಉಷ್ಣತೆಯಲ್ಲಿ ಹಾಯಿಸಿದಾಗ ಅಸಿಟೋನ್ ಉಂಟಾಗುವುದು.
ಅಸಿಟಿಕ್ ಆಮ್ಲದ ಲವಣಗಳು
[ಬದಲಾಯಿಸಿ]ಈ ಆಮ್ಲದ ಎರಡು ಬಗೆಯ ಲವಣಗಳಿವೆ: ೧. ಕರಗುವ ನಾರ್ಮಲ್ ಅಸಿಟೇಟ್ಗಳು. ೨ ಕರಗದ ಪ್ರತ್ಯಾಮ್ಲೀಯ ಅಸಿಟೇಟ್ಗಳು. ಸಾಮಾನ್ಯ ಅಸಿಟೇಟುಗಳಲ್ಲಿ ಮುಖ್ಯವಾದುವು ಸೋಡಿಯಂ ಅಸಿಟೇಟ್, ಸೀಸದ ಅಸಿಟೇಟ್. ಪ್ರತ್ಯಾಮ್ಲೀಯ ಅಸಿಟೇಟುಗಳಲ್ಲಿ ಮುಖ್ಯವಾದುವು ತಾಮ್ರದ ಅಸಿಟೇಟ್, ಫೆರಿಕ್ ಅಸಿಟೇಟ್, ಅಲ್ಯೂಮಿನಿಯಂ ಅಸಿಟೇಟ್ ಮತ್ತು ಕ್ರೋಮಿಯಂ ಅಸಿಟೇಟ್. ತಾಮ್ರದ ಅಸಿಟೇಟನ್ನು ವರ್ಡಿಗ್ರಿಸ್ ಎನ್ನುವರು. ನಾರ್ಮಲ್ ಫೆರಿಕ್ ಅಸಿಟೇಟ್ ಕಾಯಿಸಿದಾಗ ಕೆಂಪುವತ್ತರವುಳ್ಳ ಪ್ರತ್ಯಾಮ್ಲೀಯ ಫೆರಿಕ್ ಅಸಿಟೇಟ್ ಉಂಟಾಗುವುದು. ಪ್ರತ್ಯಾಮ್ಲೀಯ ಅಸಿಟೇಟುಗಳನ್ನು ಬಟ್ಟೆಗೆ ಬಣ್ಣ ಹಾಕುವಾಗ ಮಾರ್ಡಂಟ್ ಆಗಿ ಉಪಯೋಗಿಸುವರು.
ಉಪಯೋಗಗಳು
[ಬದಲಾಯಿಸಿ]ಕಾಲಿನ ಆಣಿಯನ್ನು ತೆಗೆಯಲು ಗ್ಲೇಷಿಯಲ್ ಆಮ್ಲವನ್ನು ಉಪಯೋಗಿಸುವರು. ದುರ್ಬಲ ಆಮ್ಲ ಅಥವಾ ವಿನೆಗರನ್ನು ಜ್ವರ ಬಂದಾಗ ಚರ್ಮಕ್ಕೆ ಸವರಿದರೆ ತಂಪು ಮಾಡುವುದು. ಔಷಧಿಯಾಗಿ ಸೇವನೆಗೆ ಒಳ್ಳೆಯ ಗುಣಗಳನ್ನು ಪಡೆದಿಲ್ಲವಾದರೂ ೫%ರಷ್ಟು ಆಮ್ಲವನ್ನು ಅಡಿಗಡಿಗೆ ತೆಗೆದುಕೊಂಡರೆ ದೇಹದ ತೂಕ ತಗ್ಗಿಸುವುದೆಂದು ಹೇಳುವರು.[೧೩][೧೪][೧೫] ಪೊಟಾಸಿಯಂ ಅಸಿಟೇಟ್ ರಕ್ತದಲ್ಲಿ ಕಾರ್ಬನೇಟಾಗಿ ಉತ್ಕರ್ಷಿಸಲ್ಪಡುವುದರಿಂದ ರಕ್ತದಲ್ಲಿ ಕ್ಷಾರೀಯ ಸ್ವಭಾವವನ್ನು ಹೆಚ್ಚಿಸುವುದಕ್ಕಾಗಲಿ ಅಥವಾ ಮೂತ್ರದ ಆಮ್ಲತೆಯನ್ನು ಕುಗ್ಗಿಸುವುದಕ್ಕಾಗಲಿ ಪೊಟಾಸಿಯಂ ಅಸಿಟೇಟನ್ನು ಔಷಧಿಯಾಗಿ ಕೊಡುವರು. ಆಹಾರದ ಅಂಶಗಳಿಂದ ಕಾರ್ಬೊಹೈಡ್ರೇಟ್ಗಳು ಮತ್ತು ಕೊಬ್ಬುಗಳು ದೇಹದಲ್ಲಿ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗೊಳಪಟ್ಟಾಗ, ಕೋಶಗಳಲ್ಲಿ ಅಸಿಟಿಕ್ ಆಮ್ಲ ಅಸಿಟೈಲ್ ಕೊ ಎನ್ಜೈ಼ಮ್ A ಎಂಬ ರೂಪದಲ್ಲಿ ಉತ್ಪತ್ತಿಯಾಗುವುದು. ಮೂತ್ರದಲ್ಲಿ ಆಲ್ಬುಮಿನ್ ಎಂಬ ಪ್ರೋಟೀನನ್ನು ಕಂಡುಹಿಡಿಯಲು ಈ ಸಾಮಾನ್ಯ ಆಮ್ಲವನ್ನು ಬಳಸುವರು. ನಾಲ್ಕು ಅಥವಾ ಐದು ಮಿ. ಲೀ. ಗಳಷ್ಟು ಶೋಧಿಸಿದ ಮೂತ್ರವನ್ನು ಪ್ರನಾಳದಲ್ಲಿ ತೆಗೆದುಕೊಂಡು ಕಾಯಿಸಬೇಕು. ಮೂತ್ರದಲ್ಲಿ ಆಲ್ಬುಮಿನ್ ಇದ್ದರೆ ಮಾಸಲು ಬಿಳುಪು ಬರುವುದು. ಈ ಬಣ್ಣ ಮೂತ್ರದ ಫಾಸ್ಫೇಟ್ಗಳಿಂದಲೂ ಬರುವುದು. ಐದಾರು ತೊಟ್ಟು ೫%-೧೦% ರಷ್ಟು ಅಸಿಟಿಕ್ ಆಮ್ಲವನ್ನು ಮೂತ್ರಕ್ಕೆ ಸೇರಿಸಿ ಕುದಿಸಿದಾಗ ಫಾಸ್ಫೇಟಿದ್ದರೆ ವಿಲೀನವಾಗುವುದು. ಆಲ್ಬುಮಿನ್ ಇದ್ದರೆ ಬಿಳುಪಾಗಿಯೇ ಉಳಿಯುವುದು. ಇಲ್ಲದಿದ್ದರೆ ಮೂತ್ರ ಮೊದಲಿನ ಬಣ್ಣವನ್ನೇ ಹೊಂದಿರುವುದು. ಅತಿ ದುರ್ಬಲ ಆಮ್ಲವನ್ನು ಕೆಮ್ಮಿನ ಔಷಧಿಯಲ್ಲಿ ಕೆಲವು ವೇಳೆ ಬಳಸುವರು. ಸಾಮಾನ್ಯವಾಗಿ ಉತ್ಕರ್ಷಣ ಮತ್ತು ಅಪಕರ್ಷಣಕಾರಿಗಳಿಗೆ ಬಗ್ಗದ ಈ ಆಮ್ಲವನ್ನು ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳಲ್ಲಿ ದ್ರವ ವಸ್ತುವನ್ನಾಗಿ ಬಳಸುವರು. ರಬ್ಬರ್ ದ್ರವವನ್ನು ಗಟ್ಟಿ ಮಾಡುವುದಕ್ಕೆ, ಪ್ಲಾಸ್ಟಿಕ್ಕು, ಔಷಧಿಗಳು, ಬಣ್ಣಗಳು, ಕ್ರಿಮಿನಾಶಕಗಳು, ಫೋಟೋಗ್ರಾಫಿಕ್ ಫಿಲ್ಮ್ ಮತ್ತು ರೆಯಾನ್ ತಯಾರಿಕೆಯಲ್ಲಿ ಬೇಕಾಗುವ ಸೆಲ್ಯುಲೋಸ್ ಅಸಿಟೇಟ್ ತಯಾರಿಕೆಯಲ್ಲಿ, ಅಸಿಟೋನ್, ಅಸಿಟೇಟ್, ಎಸ್ಟರ್ ಇವುಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಇದನ್ನು ಉಪಯೋಗಿಸುವರು.
ಉಲ್ಲೇಖಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ Scientific literature reviews on generally recognised as safe (GRAS) food ingredients. National Technical Information Service. 1974. p. 1.
- ↑ "Chemistry", volume 5, Encyclopedia Britannica, 1961, page 374
- ↑ IUPAC, Commission on Nomenclature of Organic Chemistry (1993). "Table 28(a) Carboxylic acids and related groups. Unsubstituted parent structures". A Guide to IUPAC Nomenclature of Organic Compounds (Recommendations 1993). Blackwell Scientific publications. ISBN 0-632-03488-2. Archived from the original on 2018-12-25. Retrieved 2016-08-04.
- ↑ "Acetic Acid – PubChem Public Chemical Database". The PubChem Project. USA: National Center for Biotechnology Information.
- ↑ Ripin, D. H.; Evans, D. A. (4 November 2005). "pKa Table" (PDF). Archived from the original (PDF) on 22 July 2015. Retrieved 19 July 2015.
{{cite web}}: Unknown parameter|deadurl=ignored (help) - ↑ ೬.೦ ೬.೧ ಉಲ್ಲೇಖ ದೋಷ: Invalid
<ref>tag; no text was provided for refs namedPGCH - ↑ "Acetic acid". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ Martin, Geoffrey (1917). Industrial and Manufacturing Chemistry (Part 1, Organic ed.). London: Crosby Lockwood. pp. 330–331.
- ↑ Hintermann, Lukas; Labonne, Aurélie (2007). "Catalytic Hydration of Alkynes and Its Application in Synthesis". Synthesis. 2007 (8): 1121. doi:10.1055/s-2007-966002.
- ↑ Armarego, W.L.F.; Chai, Christina (2009). Purification of Laboratory Chemicals, 6th edition. Butterworth-Heinemann. ISBN 978-1-85617-567-8.
- ↑ "ICSC 0363 – ACETIC ACID". International Programme on Chemical Safety. June 5, 2010.
- ↑ "Occupational Safety and Health Guideline for Acetic Acid" (PDF). Centers for Disease Control and Prevention. Retrieved May 8, 2013.
- ↑ Madhusudhan, V. L. (8 April 2015). "Efficacy of 1% acetic acid in the treatment of chronic wounds infected with Pseudomonas aeruginosa: prospective randomised controlled clinical trial". International Wound Journal. 13 (6): 1129–1136. doi:10.1111/iwj.12428. ISSN 1742-481X. PMC 7949569. PMID 25851059. S2CID 4767974.
- ↑ Ryssel, H.; Kloeters, O.; Germann, G.; Schäfer, Th; Wiedemann, G.; Oehlbauer, M. (1 August 2009). "The antimicrobial effect of acetic acid—an alternative to common local antiseptics?". Burns. 35 (5): 695–700. doi:10.1016/j.burns.2008.11.009. ISSN 1879-1409. PMID 19286325.
- ↑ "Antiseptics on Wounds: An Area of Controversy". www.medscape.com. Retrieved 15 August 2016.
ಬಾಹ್ಯ ಸಂಪರ್ಕಗಳು
[ಬದಲಾಯಿಸಿ]- International Chemical Safety Card 0363
- National Pollutant Inventory – Acetic acid fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Method for sampling and analysis
- 29 CFR 1910.1000, Table Z-1 (US Permissible exposure limits)
- ChemSub Online: Acetic acid
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of acetic acid
- Acetic acid bound to proteins in the PDB
- Swedish Chemicals Agency. Information sheet – Acetic Acid Archived 2015-02-07 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ.
- Pages with reference errors
- Pages using the JsonConfig extension
- CS1 errors: unsupported parameter
- Chemical articles without CAS registry number
- Chemicals without a PubChem CID
- Articles without InChI source
- Chemical pages without ChemSpiderID
- Articles without EBI source
- Articles without KEGG source
- Articles without UNII source
- ECHA InfoCard ID from Wikidata
- E number from Wikidata
- Articles containing unverified chemical infoboxes
- ವೆಬ್ ಆರ್ಕೈವ್ ಟೆಂಪ್ಲೇಟಿನ ವೇಬ್ಯಾಕ್ ಕೊಂಡಿಗಳು
- ರಸಾಯನಶಾಸ್ತ್ರ
- ವಿಜ್ಞಾನ
- ಮೈಸೂರು ವಿಶ್ವವಿದ್ಯಾನಿಲಯ ವಿಶ್ವಕೋಶ