ಬೆಂಜೀ಼ನ್
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). > | |
| Infobox references | |
C6H6 ಎಂಬ ಆಣ್ವಿಕ ಸೂತ್ರದೊಂದಿಗೆ ಬೆಂಜ಼ೀನ್ ಸಾವಯವ ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತವಾಗಿದೆ. ಬೆಂಜ಼ೀನ್ ಅಣುವು ಆರು ಇಂಗಾಲದ ಪರಮಾಣುಗಳಿಂದ ಕೂಡಿದ್ದು, ಪ್ರತಿಯೊಂದಕ್ಕೂ ಒಂದು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿನೊಂದಿಗೆ ಒಂದು ಉಂಗುರದ ರೂಪದಲ್ಲಿ ಸೇರಿಕೊಳ್ಳುತ್ತದೆ. ಇದು ಇಂಗಾಲ ಮತ್ತು ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುಗಳನ್ನು ಮಾತ್ರ ಹೊಂದಿರುವುದರಿಂದ, ಬೆಂಜ಼ೀನ್ ಅನ್ನು ಹೈಡ್ರೋಕಾರ್ಬನ್ ಎಂದು ವರ್ಗೀಕರಿಸಲಾಗಿದೆ.[೧] ಇದು ಸದೃಶಚಕ್ರೀಯ (ಹೋಮೊಸೈಕ್ಲಿಕ್) ಹೈಡ್ರೊಕಾರ್ಬನ್.
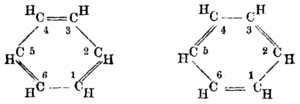
ಬೆಂಜ಼ೀನ್ ಕಚ್ಚಾ ತೈಲದ ನೈಸರ್ಗಿಕ ಘಟಕವಾಗಿದೆ ಮತ್ತು ಇದು ಪ್ರಾಥಮಿಕ ಪೆಟ್ರೋಕೆಮಿಕಲ್ಗಳಲ್ಲಿ ಒಂದಾಗಿದೆ . ಇಂಗಾಲದ ಪರಮಾಣುಗಳ ನಡುವಿನ ಚಕ್ರದ ನಿರಂತರ ಪೈ ಬಂಧಗಳಿಂದಾಗಿ, ಬೆಂಜ಼ೀನ್ ಅನ್ನು ಆರೊಮ್ಯಾಟಿಕ್ ಹೈಡ್ರೋಕಾರ್ಬನ್ ಎಂದು ವರ್ಗೀಕರಿಸಲಾಗಿದೆ. ಪ್ರಾಚೀನ ಅಮೆರಿಕನ್ ಮತ್ತು ಬ್ರಿಟಿಷ್ ತಾಂತ್ರಿಕ ಸಾಹಿತ್ಯಗಳಲ್ಲಿ ಇದನ್ನು ಬೆನ್ಜ಼ಾಲ್ ಎಂಬ ಜರ್ಮನ್ ಹೆಸರಿನಿಂದಲೇ ಸೂಚಿಸುವುದಿತ್ತು. ಪ್ರಚಲಿತ ಕ್ರಮದಲ್ಲಿ ಕಡಿಮೆ ಶುದ್ಧತೆಯ ಬೆನ್ಜ಼ೀನನ್ನು ಬೆನ್ಜ಼ಾಲ್ ಎಂದು ಕರೆಯುವುದಿದೆ. ಆರೊಮ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳೆಲ್ಲ ಬೆನ್ಜ಼ೀನ್ ಜನ್ಯವಾದ್ದರಿಂದ ಅವುಗಳ ರಚನೆಯಲ್ಲಿ ಬೆನ್ಜ಼ೀನ್ ಉಂಗುರ (ರಿಂಗ್) ಕಾಣಬಹುದು. ಬೆನ್ಜ಼ೀನ್ ಜನ್ಯ ಸಂಯುಕ್ತಗಳೆಲ್ಲವಕ್ಕೂ ತೀಕ್ಷ್ಣ ಸುವಾಸನೆ (ಆರೊಮ) ಉಂಟು. ಬೆನ್ಜ಼ೀನ್ ಹೈಡ್ರೊಕಾರ್ಬನ್ನಿನಲ್ಲಿ ಆರು ಇಂಗಾಲದ ಪರಮಾಣುಗಳು ಕ್ರಮಷಡ್ಭುಜಾಕಾರದಲ್ಲಿ ಜೋಡಣೆಗೊಂಡಿದ್ದು ಪರಸ್ಪರ ಬಂಧಿಸಿಕೊಂಡಿರುವ ಬಂಧಗಳು ಪರ್ಯಾಯ ಏಕಬಂಧ ಮತ್ತು ದ್ವಿಬಂಧಗಳಾಗಿರುತ್ತವೆ. ಈ ಕ್ರಮದಂತೆ ಬೆನ್ಜ಼ೀನಿನ ಅಣು ರಚನೆಯನ್ನು ಪಕ್ಕಕ್ಕೆ ಕೊಟ್ಟಿದೆ.
ತಯಾರಿಕೆ
[ಬದಲಾಯಿಸಿ]ಮೊತ್ತಮೊದಲಿಗೆ ಇಂಗ್ಲಿಷ್ ಭೌತ ಹಾಗೂ ರಸಾಯನ ವಿಜ್ಞಾನಿ ಮೈಕೆಲ್ ಫ್ಯಾರಡೆ (೧೭೯೧-೧೮೬೭) ಸ್ವಾಭಾವಿಕ ಎಣ್ಣೆಗಳ ಆವಿಯನ್ನು ಹೆಚ್ಚಿನ ಒತ್ತಡಕ್ಕೆ ಒಳಪಡಿಸುವುದರಿಂದ ಬೆನ್ಜ಼ೀನನ್ನು ತಯಾರಿಸಿದ (೧೮೨೫).[೨][೩] ಮುಂದೆ ೧೮೪೫ರಲ್ಲಿ ಜರ್ಮನಿಯ ರಸಾಯನ ವಿಜ್ಞಾನಿ ಹಾಫ್ಮನ್ (೧೮೧೮-೯೨) ಬೆನ್ಜ಼ೀನನ್ನು ಕಲ್ಲಿದ್ದಲಿನ ಟಾರೆಣ್ಣೆಯಿಂದಲೂ ತಯಾರಿಸಬಹುದೆಂದು ಸೂಚಿಸಿದ.[೪]
ಬಿಟ್ಯೂಮಿನಸ್ ಕಲ್ಲಿದ್ದಲಿನ ಚೂರುಗಳನ್ನು ೧೦೦೦-೩೦೦೦ ಉಷ್ೞತೆಯಲ್ಲಿ ವಾಯು ರಹಿತ ರಿಟಾರ್ಟುಗಳಲ್ಲಿ ಕಾಸಿದಾಗ ೩% ರಷ್ಟು ಟಾರೆಣ್ಣೆ ಉಂಟಾಗುತ್ತದೆ. ಇದರಲ್ಲಿ ಅನೇಕ ಆರೊಮ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳೂ ಇರುವುವು. ಈ ಟಾರೆಣ್ಣೆಯನ್ನು ಭಿನ್ನಾಸವನಕ್ಕೆ ಈಡುಮಾಡಿದಾಗ ಬೇರೆ ಬೇರೆ ಉಷ್ಣತೆಗಳಲ್ಲಿ ಬೇರೆ ಬೇರೆ ಅಂಶಗಳು ಆವಿರೂಪದಲ್ಲಿ ಹೊರಬರುತ್ತದೆ. ಇವುಗಳ ಪೈಕಿ ಒಂದಾದ ಲೈಟ್ ಆಯಿಲ್ ಅಂಶದಲ್ಲಿ ಬೆನ್ಜ಼ೀನ್, ಟಾಲ್ಯೂಯಿನ್, ತಯಾಫೀನ್ ಮುಂತಾದ ವಸ್ತುಗಳೂ ಪಿರಿಡೀನ್ ಎಂಬ ಕ್ಷಾರ ಕಲ್ಮಷವೂ ಫೀನಾಲ್ ಎಂಬ ಆಮ್ಲೀಯ ಕಲ್ಮಷವೂ ಸೇರಿರುತ್ತವೆ. ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲ ಮತ್ತು ಸೋಡಿಯಮ್ ಹೈಡ್ರಾಕ್ಸೈಡುಗಳನ್ನು ಉಪಯೋಗಿಸಿ ಕ್ಷಾರ ಮತ್ತು ಆಮ್ಲೀಯ ಕಲ್ಮಷಗಳನ್ನು ಬೇರ್ಪಡಿಸಬಹುದು. ಲೈಟ್ ಆಯಿಲ್ ಅಂಶವನ್ನು ಬಟ್ಟಿ ಇಳಿಸಿದರೆ ಉಷ್ಣತೆಗೆ ಅನುಗುಣವಾಗಿ ಮೂರು ಭಾಗಗಳು ಬರುತ್ತವೆ: ೯೦% ಬೆನ್ಜ಼ಾಲ್, ೫೦% ಬೆನ್ಜ಼ಾಲ್, ಲೀನಕಾರಿ (ಸಾಲ್ವೆಂಟ್) ನ್ಯಾಫ್ಥ.
೯೦% ಬೆನ್ಜ಼ಾಲಿನಲ್ಲಿ ೭೦% ಬೆನ್ಜ಼ೀನ್ ಮತ್ತು ೫೦% ಬೆನ್ಜ಼ಾಲಿನಲ್ಲಿ ೪೬% ಬೆನ್ಜ಼ೀನ್ ಇರುತ್ತದೆ. ಇವನ್ನು ಪುನಃ ಬಟ್ಟಿ ಇಳಿಸಿದಾಗ ೮೦ ಉಷ್ೞತೆಯಲ್ಲಿ ಆವಿರೂಪಕ್ಕೆ ಬರುವ ಭಾಗದಲ್ಲಿಯ ಬೆನ್ಜ಼ೀನಿನ ಜೊತೆ ಸ್ವಲ್ಪ ತಯಾಫೀನೂ ಬರುತ್ತದೆ. ಇದನ್ನು ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದೊಂದಿಗೆ ವರ್ತಿಸಿ ಶುದ್ಧ ಬೆನ್ಜ಼ೀನನ್ನು ಪಡೆಯಬಹುದು. ಒಂದು ಟನ್ ಕಲ್ಲಿದ್ದಲಿನಿಂದ ಸುಮಾರು ೯ ಲೀಟರುಗಳಷ್ಟು ಬೆನ್ಜ಼ೀನನ್ನು ತಯಾರಿಸಬಹುದು.
ಬೆನ್ಜ಼ೀನನ್ನು ಕೆಲವು ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳಿಂದಲೂ ಪಡೆಯುವುದಿದೆ. ಅಸಿಟಲೀನನ್ನು ಕಾದ ಗಾಜಿನ ಕೊಳವೆಯ ಮೂಲಕ ಹಾಯಿಸಿದಾಗ, ತ್ಯಾಲಿಕ್ ಆಮ್ಲವನ್ನು ಕ್ಯಾಲ್ಸಿಯಮ್ ಆಕ್ಸೈಡಿನ ಜೊತೆ ಕಾಸಿದಾಗ ಮತ್ತು ಫೀನಾಲನ್ನು ಸತುವಿನ ಪುಡಿಯ ಜೊತೆ ಕಾಸಿದಾಗ ಬೆನ್ಜ಼ೀನ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
ಗುಣಗಳು
[ಬದಲಾಯಿಸಿ]ಕುದಿಬಿಂದು ೮೦.೧; ಹೆಪ್ಪುಗಟ್ಟುವ ಉಷ್ಣತೆ ೫.೪-೫.೫೦C. ಬೆಂಜ಼ೀನ್ ಬಣ್ಣವಿಲ್ಲದ ಮತ್ತು ಹೆಚ್ಚು ಸುಡುವ ದ್ರವವಾಗಿದ್ದು, ಸಿಹಿ ವಾಸನೆಯನ್ನು ಹೊಂದಿರುತ್ತದೆ ಮತ್ತು ಇದು ಪೆಟ್ರೋಲ್ (ಗ್ಯಾಸೋಲಿನ್) ಕೇಂದ್ರಗಳ ಸುತ್ತಲಿನ ಸುವಾಸನೆಗೆ ಕಾರಣವಾಗಿದೆ. ಸಾಂದ್ರತೆ ೨೫೦ನಲ್ಲಿ ೦.೮೭೪, ವಕ್ರೀಭವನಾಂಕ ೧.೪೯೮. ನೀರಿನಲ್ಲಿ ವಿಲೀನವಾಗುವುದಿಲ್ಲ. ಈಥರ್ ಆಲ್ಕೊಹಾಲ್ ಮುಂತಾದ ದ್ರವಗಳಲ್ಲಿ ವಿಲೀನವಾಗುತ್ತದೆ.
ಬೆನ್ಜ಼ೀನ್ ಅಣುಗಳಲ್ಲಿರುವ ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳನ್ನು ಬೇರೆ ಬೇರೆ ಪರಮಾಣು ಇಲ್ಲವೆ ಪರಮಾಣು ಪುಂಜಗಳಿಂದ ಬದಲಿಸಬಹುದು. ಉದಾಹರಣೆಗೆ ಹೈಡ್ರೊಜನ್ನಿನ ಒಂದು ಪರಮಾಣುವನ್ನು ಕ್ಲೋರೀನ್ ಪರಮಾಣುವಿನಿಂದ ಬದಲಾಯಿಸಿದರೆ ಕ್ಲೋರೊಬೆನ್ಜ಼ೀನ್ ಉಂಟಾಗುತ್ತದೆ. ಹೈಡ್ರೊಜನ್ನಿನ ಎರಡು ಅಥವಾ ಹೆಚ್ಚು ಪರಮಾಣುಗಳನ್ನು ಇತರ ಪರಮಾಣು ಅಥವಾ ಪರಮಾಣು ಪುಂಜಗಳಿಂದ ಬದಲಿಸಿದರೆ ಉಂಟಾಗುವ ಜನ್ಯವಸ್ತುಗಳನ್ನು ಹೆಸರಿಸುವಾಗ ಬದಲಿ ಸ್ಥಾನಗಳನ್ನು ಸೂಚಿಸಬೇಕಾಗುತ್ತದೆ. ಅದಕ್ಕಾಗಿ ಬೆನ್ಜ಼ೀನ್ ಅಣುವಿನಲ್ಲಿಯ ಯಾವುದಾದರೊಂದು ಸ್ಥಾನವನ್ನು ೧ ಎಂದು ಕರೆದು ಅಲ್ಲಿಂದ ಪ್ರದಕ್ಷಿಣೆ ದಿಶೆಯಲ್ಲಿ ಬರುವ ಸ್ಥಾನಗಳನ್ನು ಅನುಕ್ರಮವಾಗಿ ೨, ೩, ೪, ೫, ಮತ್ತು ೬ ಎಂದು ಕರೆಯುವುದಿದೆ.
ಬೆನ್ಜ಼ೀನ್ ಕ್ಲೋರೀನಿನೊಡನೆ ವರ್ತಿಸಿದಾಗ ಪಲ್ಲಟನೆಯ ಪರಿವರ್ತನೆ ಉಂಟಾಗಿ ಕ್ಲೋರೊಬೆನ್ಜ಼ೀನ್ (C6H5Cl), ಡೈಕ್ಲೋರೊಬೆನ್ಜ಼ೀನ್ [C6H4Cl2 (೧,೪) ಮತ್ತು (೧, ೨)], ಟ್ರೈಕ್ಲೋರೊಬೆನ್ಜ಼ೀನ್ [C6H3Cl3 (೧,೨,೪)], ಟೆಟ್ರಕ್ಲೋರೊಬೆನ್ಜ಼ೀನ್ [(C6H2Cl4 (೧, ೨, ೩, ೫)], ಈ ಸಂಯುಕ್ತಗಳೂ ಸಂಕಲನ ಪರಿವರ್ತನೆ ಉಂಟಾಗಿ ಬೆನ್ಜ಼ೀನ್ ಡೈಕ್ಲೋರೈಡ್ (C6H6Cl2), ಬೆನ್ಜ಼ೀನ್ ಟೆಟ್ರಕ್ಲೋರೈಡ್ (C6H6Cl4) ಮತ್ತು ಬೆನ್ಜ಼ೀನ್ ಹೆಕ್ಸಕ್ಲೋರೈಡ್ (C6H6Cl6) ಸಂಯುಕ್ತಗಳೂ ಉಂಟಾಗುತ್ತದೆ. ಕಬ್ಬಿಣ, ಅಲ್ಯೂಮಿನಿಯಮ್ ಕ್ಲೋರೈಡ್ ಮುಂತಾದ ವೇಗವರ್ಧಕಗಳ ಸಂಪರ್ಕದಲ್ಲಿ ಪಲ್ಲಟನೆಯ ಪರಿವರ್ತನೆಗಳು ಸುಲಭವಾಗಿ ನಡೆಯುತ್ತವೆ.
ಸಾರ ನೈಟ್ರಿಕ್ ಆಮ್ಲದ ಜೊತೆಯಲ್ಲಿ ನೈಟ್ರೊಬೆನ್ಜ಼ೀನ್ (C6H5NO2). ಡೈನೈಟ್ರೊಬೆನ್ಜ಼ೀನ್ [ (C6H4(NO2)2 (೧, ೩) ] ಮತ್ತು ಟ್ರೈನೈಟ್ರೊಬೆನ್ಜ಼ೀನ್ [ (C6H3(NO2)3 (೧, ೩, ೫) ] ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ. ಸಾರ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದೊಡನೆ ವರ್ತಿಸಿದಾಗ ಬೆನ್ಜ಼ೀನ್ ಸಲ್ಫೋನಿಕ್ ಆಮ್ಲ (C6H5SO3H), ಬೆನ್ಜ಼ೀನ್ ಡೈಸಲ್ಫೋನಿಕ್ ಆಮ್ಲ [( C6H4(SO3H)2 (೧, ೩)] ಮತ್ತು ಬೆನ್ಜ಼ೀನ್ ಟ್ರೈಸಲ್ಫೊನಿಕ್ ಆಮ್ಲಗಳು [ C6H3(SO3H)3 (೧, ೩, ೫) ] ಉಂಟಾಗುತ್ತದೆ. ಕಾಸಿದ ನಿಕ್ಕಲ್ ವೇಗವರ್ಧಕದ ಸಂಪರ್ಕದಲ್ಲಿ, ಹೈಡ್ರೊಜನಿನೊಂದಿಗೆ ಬೆನ್ಜ಼ೀನ್ ವರ್ತಿಸಿದಾಗ ಸೈಕ್ಲೊಹೆಕ್ಸೇನ್ ಲಭಿಸುತ್ತದೆ. ಓಜ಼ೋನಿನ ಜೊತೆಯಲ್ಲಿ ವರ್ತಿಸಿ ಬೆನ್ಜ಼ೀನ್ ಟ್ರೈಓಜ಼ೋನೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಮೀಥೈಲ್ ಕ್ಲೋರೈಡಿನ ಮೇಲೆ, ಜಲರಹಿತ ಅಲ್ಯೂಮಿನಿಯಮ್ ಕ್ಲೋರೈಡ್ ಸಂಪರ್ಕದಲ್ಲಿ ವರ್ತಿಸಿ ಟಾಲ್ಯೂಯೀನ್ (C6H5CH3), ಡೈಮೀಥೈಲ್ ಬೆನ್ಜ಼ೀನ್ [C6H4(CH3)2] ಮತ್ತು ಟ್ರೈಮೀಥೈಲ್ ಬೆನ್ಜೀ಼ನುಗಳು [C6H3(CH3)3] (ಇಲ್ಲಿ ಫ್ರೀಡಲ್ ಮತ್ತು ಕ್ರಾಫ್ಟ್ ವಿಧಾನದ ಬಳಕೆ ಇದೆ) ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ.
ಉಪಯೋಗಗಳು
[ಬದಲಾಯಿಸಿ]ಬೆನ್ಜ಼ೀನ್ ದ್ರವವಾಗಿ, ಮೋಟಾರು ವಾಹಗಳಲ್ಲಿ ಉರುವಲಿನ ರೂಪದಲ್ಲಿ ಬಳಕೆ ಇದೆ. ಬಣ್ಣಗಳ ಮತ್ತು ಔಷಧಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಇದರ ಬಳಕೆ ಹೆಚ್ಚು.
ಇದನ್ನು ಪ್ರಾಥಮಿಕವಾಗಿ ಹೆಚ್ಚು ಸಂಕೀರ್ಣವಾದ ರಚನೆಯಾದ ಎಥೈಲ್ ಬೆಂಜ಼ೀನ್ ಮತ್ತು ಕ್ಯುಮೀನ್ನಂತಹ ರಾಸಾಯನಿಕಗಳ ತಯಾರಿಕೆಗೆ ಪೂರ್ವಭಾವಿಯಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. ಅದರಲ್ಲಿ ವಾರ್ಷಿಕವಾಗಿ ಶತಕೋಟಿ ಕಿಲೋಗ್ರಾಂಗಳಷ್ಟು ಉತ್ಪಾದಿಸಲಾಗುತ್ತದೆ. ಬೆಂಜ಼ೀನ್ ಸ್ವತಃ ಗ್ಯಾಸೋಲಿನ್ನಲ್ಲಿ 1% ಕ್ಕಿಂತ ಕಡಿಮೆಗೆ ಸೀಮಿತವಾಗಿದೆ ಏಕೆಂದರೆ ಇದು ಮಾನವರಲ್ಲಿ ಕ್ಯಾನ್ಸರ್ಕಾರಕ ಆಗಿದೆ. ಹೆಚ್ಚಿನ ಕೈಗಾರಿಕೇತರ ಅನ್ವಯಿಕೆಗಳನ್ನು ಇದೊಂದೇ ಕಾರಣಕ್ಕಾಗಿ ಸೀಮಿತಗೊಳಿಸಲಾಗಿದೆ.
ಬೆನ್ಜ಼ೀನಿನ ರಚನೆ
[ಬದಲಾಯಿಸಿ]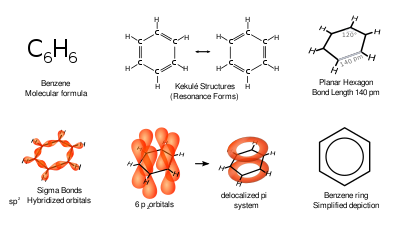
C6H6 ಇದರ ಅಣುಸೂತ್ರ. ಇಷ್ಟೇ ಮೊತ್ತದ ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳುಳ್ಳ ತೃಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ನಿನ ಸೂತ್ರದೊಂದಿಗೆ(C6H14) ಬೆನ್ಜ಼ೀನನ್ನು ಹೋಲಿಸಿದರೆ ಇದರಲ್ಲಿ ೮ ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳು ಕಡಿಮೆ ಇವೆ. ಹೀಗಾಗಿ ಬೆನ್ಜ಼ೀನಿನಲ್ಲಿ ಅತೃಪ್ತ ಲಕ್ಷಣವೇ ಹೆಚ್ಚಾಗಿ ಕಂಡುಬರುವುದರಿಂದ ಸಂಕಲನಕ್ರಿಯೆಯಲ್ಲಿ ಪಾಲ್ಗೊಳ್ಳಬಹುದು ಎಂದು ತಿಳಿಯಬಹುದು. ಆದರೆ ಇದು ಸುಲಭವಾಗಿ ಸಂಕಲನಕ್ರಿಯೆಗಳಲ್ಲಿ ಭಾಗವಹಿಸುವುದಿಲ್ಲ. ಬೆನ್ಜ಼ೀನ್ ತೀಕ್ಷ್ಣ ಬೆಳಕಿನಲ್ಲಿ ಕ್ಲೋರೀನ್ ಮತ್ತು ಬ್ರೋಮೀನುಗಳೊಡನೆ, ೮ ಪರಮಾಣುಗಳಿಗೆ ಬದಲಾಗಿ ಕೇವಲ ೬ ಪರಮಾಣುಗಳೊಡನೆ ಮಾತ್ರ ವರ್ತಿಸುತ್ತದೆ. ೬ ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳು ನಿಕ್ಕಲ್ ಸಂಪರ್ಕದಲ್ಲಿ ಬೆನ್ಜ಼ೀನಿನೊಡನೆ ಸಂಕಲನ ಹೊಂದಿ ಸೈಕ್ಲೊಹೆಕ್ಸೇನ್ ಉಂಟಾಗುತ್ತದೆ. ಒಂದು ಬೆನ್ಜ಼ೀನ್ ಅಣು ಓಜ಼ೋನಿನ ಮೂರು ಅಣುಗಳೊಡನೆ ವರ್ತಿಸಿ ಬೆನ್ಜ಼ೀನ್ ಟ್ರೈಓಜ಼ೋನೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ. ಬೆನ್ಜ಼ೀನ್ ಟ್ರೈಓಜ಼ೋನೈಡ್ ಜಲವಿಭಜನೆ ಹೊಂದಿ ಹೈಡ್ರೊಜನ್ ಪರಾಕ್ಸೈಡಿನ ಮೂರು ಅಣುಗಳೂ ಗ್ಲೈಆಕ್ಸಾಲಿನ ಮೂರು ಅಣುಗಳೂ ಉಂಟಾಗುತ್ತವೆ. ಈ ಕ್ರಿಯೆಯಿಂದ ಬೆನ್ಜ಼ೀನ್ ಅಣುವಿನಲ್ಲಿ ಮೂರು ದ್ವಿಬಂಧಗಳಿವೆ ಎಂಬುದು ನಿರ್ಧಾರವಾಗಿದೆ.
ಬೆನ್ಜ಼ೀನ್ ಚಕ್ರದಲ್ಲಿಯ ಆರು ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳ ಪೈಕಿ ಯಾವುದಾದರೂ ಒಂದನ್ನು ಪಲ್ಲಟನೆಯ ಪರಿವರ್ತನೆಯಿಂದ ಕ್ಲೋರೀನ್, ಇಲ್ಲವೆ ನೈಟ್ರಿಕ್ ಆಮ್ಲ ಅಥವಾ ಸಲ್ಫ್ಯೂರಿಕ್ ಆಮ್ಲದಿಂದ ಪರಿವರ್ತಿಸಬಹುದು.
ಅಂದರೆ ಬೆನ್ಜ಼ೀನಿನ ಅಣುರಚನೆಯಲ್ಲಿ ಕಂಡುಬರುವ ಆರು ಹೈಡ್ರೊಜನ್ನಿನ ಪರಮಾಣುಗಳು ಸಮರೀತಿಯಲ್ಲಿ ಹಂಚಿಕೊಂಡಿವೆ. ಬೆನ್ಜ಼ೀನಿನ ಈ ಲಕ್ಷಣಗಳ ಆಧಾರದ ಮೇಲೆ ಜರ್ಮನಿಯ ರಸಾಯನ ವಿಜ್ಞಾನಿ ಆಗಸ್ಟ್ ಕೆಕ್ಯೂಲೆ (೧೮೨೯-೯೬) ಇದಕ್ಕೆ ಷಡ್ಭುಜಾಕಾರದ ರಚನೆ ಸೂಚಿಸಿದ.[೫][೬] ಇದೆ ಸ್ಥಾಯೀಸೂತ್ರದ ಪ್ರಕಾರ ಬೆನ್ಜ಼ೀನ್ ಎರಡು ಆರ್ಥೊ ದ್ವಿಪಲ್ಲಟನೆಯ ಸಂಯುಕ್ತಗಳನ್ನು ಕೊಡಬೇಕು.
ಆದರೆ ಬೆನ್ಜ಼ೀನ್ ಒಂದು ಆರ್ಥೊ ದ್ವಿಪಲ್ಲಟನೆಯ ಸಂಯುಕ್ತ ಮಾತ್ರ ಕೊಡುತ್ತದೆ. ಕೆಕ್ಯೂಲೆ ಇದನ್ನು ವಿಶದಪಡಿಸಲೆಂದೇ ಚಲನಾತ್ಮಕ ಸೂತ್ರವನ್ನು ಮುಂದಿಟ್ಟ (೧೮೭೨). ಇದರ ಪ್ರಕಾರ ದ್ವಿಬಂಧಗಳು ತಮ್ಮ ಸ್ಥಾನಗಳನ್ನು ಬದಲಾಯಿಸುವುದರಿಂದ ಬೆನ್ಜ಼ೀನ್ ನಿರಂತರ ಪರಸ್ಪರ ಬದಲಾವಣೆ ಹೊಂದುವ ಎರಡು ರಚನೆಗಳನ್ನು ಪಡೆದಿದೆ.
ಕ್ಲಾಸ್ ಮತ್ರು ಬೇಯರ್ ಎಂಬ ರಸಾಯನ ವಿಜ್ಙಾನಿಗಳು ಬೆನ್ಜ಼ೀನಿನ ಸ್ಥಿರ ಲಕ್ಷಣ ವಿಶದಪಡಿಸಲು ಕೆಲವೊಂದು ರಚನೆಗಳನ್ನು ನೀಡಿದರು. ಇವರ ಪ್ರಕಾರ, ಬೆನ್ಜ಼ೀನಿನ ಅತೃಪ್ತ ಸ್ವಭಾವ ತಿಳಿಯುವುದು ಅಸಾಧ್ಯವಾದರೂ ಇದು ಹೇಗೆ ಒಂದೇ ಸಮಯದಲ್ಲಿ ಆರ್ಥೊ ಮತ್ತು ಪ್ಯಾರಾ ಪಲ್ಲಟನೆಯ ವಸ್ತುಗಳನ್ನು ನೀಡಬಲ್ಲದು ಎಂಬುದನ್ನಾದರೂ ತಿಳಿಯಬಹುದು.
ಥೀ ಎಂಬ ರಸಾಯನ ವಿಜ್ಞಾನಿ ಬೆನ್ಜೀನಿನ ಸ್ಥಿರತೆ ವಿವರಿಸಲು ಆಂಶಿಕ ವೇಲೆನ್ಸಿ ಸಿದ್ಧಾಂತವನ್ನು ಮಂಡಿಸಿದ. ಇದರ ಪ್ರಕಾರ ಪರ್ಯಾಯ ದ್ವಿಬಂಧಗಳುಳ್ಳ (ಕಾಂಜುಗೇಟೆಡ್ ಡಬ್ಬಲ್ ಬಾಂಡ್) ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಈ ಆಂಶಿಕ ವೇಲೆನ್ಸಿ ಪರಸ್ಪರ ತೃಪ್ತಿ ಹೊಂದುತ್ತದೆ.
ಎಕ್ಸ್ಕಿರಣ ಮತ್ತು ಎಲೆಕ್ಟ್ರಾನಿನ ನಮನ ಪ್ರಯೋಗಗಳಿಂದಲೂ ಬೆನ್ಜ಼ೀನಿನಲ್ಲಿರುವ ಇಂಗಾಲದ ಆರು ಪರಮಾಣುಗಳು ಒಂದು ಸಮ ಷಡ್ಭುಜದ ಆರು ಮೂಲೆಗಳಲ್ಲಿವೆ ಎಂಬುದು ಸ್ಥಿರಪಡುತ್ತದೆ. ಇತ್ತೀಚೆಗೆ ಬೆನ್ಜ಼ೀನಿನ ರಚನೆಯನ್ನು ಕಕ್ಷೀಯ ತತ್ತ್ವದಿಂದಲೂ (ಆರ್ಬೈಟಲ್ ಪ್ರಿನ್ಸಿಪಾಲ್) ವಿವರಿಸಲಾಗಿದೆ. ಈ ತತ್ತ್ವದ ಪ್ರಕಾರ ಬೆನ್ಜ಼ೀನ್ ಅಣು ಆರು ಕಾರ್ಬನ್ ಅಣುಗಳಿಂದ ಕೂಡಿದ ಸಮತಲ ಷಡ್ಭುಜದ ಆಕೃತಿಯಲ್ಲಿ ಇದೆ. ಪ್ರತಿಯೊಂದು ಕಾರ್ಬನ್ ಅಣುವೂ ಓಂದೊಂದು ಹೈಡ್ರೋಜನ್ ಅಣುವಿನೊಡನೆ ಸಂಯೋಜನೆ ಹೊಂದಿರುತ್ತದೆ. ಪರ್ಯಾಯ ದ್ವಿಬಂಧಗಳ ಬದಲು ಈ ಷಡ್ಭುಜಾಕೃತಿಯ ಮೇಲೆ ಮತ್ತು ಕಳಗೆ ವಿಸ್ತೃತವಾದ ಎಲೆಕ್ಟ್ರಾನ್ ಮೋಡಗಳು ಇರುತ್ತವೆ.
ಟಿಪ್ಪಣಿಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ Critics pointed out a problem with Kekulé's original (1865) structure for benzene: Whenever benzene underwent substitution at the ortho position, two distinguishable isomers should have resulted, depending on whether a double bond or a single bond existed between the carbon atoms to which the substituents were attached; however, no such isomers were observed. In 1872, Kekulé suggested that benzene had two complementary structures and that these forms rapidly interconverted, so that if there were a double bond between any pair of carbon atoms at one instant, that double bond would become a single bond at the next instant (and vice versa). To provide a mechanism for the conversion process, Kekulé proposed that the valency of an atom is determined by the frequency with which it collided with its neighbors in a molecule. As the carbon atoms in the benzene ring collided with each other, each carbon atom would collide twice with one neighbor during a given interval and then twice with its other neighbor during the next interval. Thus, a double bond would exist with one neighbor during the first interval and with the other neighbor during the next interval. Therefore, between the carbon atoms of benzene there were no fixed (i.e., constant) and distinct single or double bonds; instead, the bonds between the carbon atoms were identical. See pages 86–89 of Auguste Kekulé (1872) "Ueber einige Condensationsprodukte des Aldehyds" (On some condensation products of aldehydes), Liebig's Annalen der Chemie und Pharmacie, 162(1): 77–124, 309–320. From p. 89: "Das einfachste Mittel aller Stöße eines Kohlenstoffatoms ergiebt sich aus der Summe der Stöße der beiden ersten Zeiteinheiten, die sich dann periodisch wiederholen. … man sieht daher, daß jedes Kohlenstoffatom mit den beiden anderen, … daß diese Verschiedenheit nur eine scheinbare, aber keine wirkliche ist." (The simplest average of all the collisions of a carbon atom [in benzene] comes from the sum of the collisions during the first two units of time, which then periodically repeat. … thus one sees that each carbon atom collides equally often with the two others against which it bumps, [and] thus stands in exactly the same relation with its two neighbors. The usual structural formula for benzene expresses, of course, only the collisions that occur during one unit of time, thus during one phase, and so one is led to the view [that] doubly substituted derivatives [of benzene] must be different at positions 1,2 and 1,6 [of the benzene ring]. If the idea [that was] just presented — or a similar one — can be regarded as correct, then [it] follows therefrom that this difference [between the bonds at positions 1,2 and 1,6] is only an apparent [one], not a real [one].)
ಉಲ್ಲೇಖಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ "Benzene - an overview | ScienceDirect Topics". www.sciencedirect.com. Archived from the original on 2021-02-08. Retrieved 2020-11-25.
- ↑ Faraday, M. (1825). "On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat". Philosophical Transactions of the Royal Society. 115: 440–466. doi:10.1098/rstl.1825.0022. JSTOR 107752. Archived from the original on 2020-11-21. Retrieved 2012-01-15. On pages 443–450, Faraday discusses "bicarburet of hydrogen" (benzene). On pages 449–450, he shows that benzene's empirical formula is C6H6, although he doesn't realize it because he (like most chemists at that time) used the wrong atomic mass for carbon (6 instead of 12).
- ↑ Kaiser, R. (1968). "Bicarburet of Hydrogen. Reappraisal of the Discovery of Benzene in 1825 with the Analytical Methods of 1968". Angewandte Chemie International Edition in English. 7 (5): 345–350. doi:10.1002/anie.196803451.
- ↑ Hofmann, A. W. (1845). "Ueber eine sichere Reaction auf Benzol" [On a reliable test for benzene]. Annalen der Chemie und Pharmacie (in ಜರ್ಮನ್). 55 (2): 200–205, especially 204–205. doi:10.1002/jlac.18450550205. Archived from the original on 2015-11-22.
- ↑ Kekulé, F. A. (1865). "Sur la constitution des substances aromatiques". Bulletin de la Société Chimique de Paris. 3: 98–110. Archived from the original on 2015-11-14. Retrieved 2015-06-27. On p. 100, Kekulé suggests that the carbon atoms of benzene could form a "chaîne fermée" (a closed chain, a loop).
- ↑ Kekulé, F. A. (1866). "Untersuchungen über aromatische Verbindungen (Investigations of aromatic compounds)". Liebigs Annalen der Chemie und Pharmacie. 137 (2): 129–36. doi:10.1002/jlac.18661370202. Archived from the original on 2021-12-26. Retrieved 2021-12-25.
ಹೊರಗಿನ ಕೊಂಡಿಗಳು
[ಬದಲಾಯಿಸಿ]- Benzene at The Periodic Table of Videos (University of Nottingham)
- International Chemical Safety Card 0015
- USEPA Summary of Benzene Toxicity
- NIOSH Pocket Guide to Chemical Hazards
- ಟೆಂಪ್ಲೇಟು:PubChem
- Dept. of Health and Human Services: TR-289: Toxicology and Carcinogenesis Studies of Benzene
- Video Podcast of Sir John Cadogan giving a lecture on Benzene since Faraday, in 1991
- Substance profile
- ಟೆಂಪ್ಲೇಟು:ChemID
- NLM Hazardous Substances Databank – Benzene
