ಸದಸ್ಯ:Lishmaeliyaskootala/ನನ್ನ ಪ್ರಯೋಗಪುಟ
.
| |||||||||||||||
| ಸಾಮಾನ್ಯ ಮಾಹಿತಿ | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
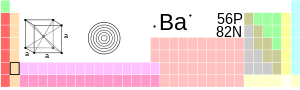
| ಹೆಸರು, ಚಿಹ್ನೆ ಮತ್ತು ಕ್ರಮಾಂಕ | ಬೇರಿಯಮ್, Ba, 56 | ||||||||||||||
| ರಾಸಾಯನಿಕ ಸರಣಿ | alkaline earth metal | ||||||||||||||
| ಗುಂಪು, ಆವರ್ತ, ಖಂಡ | 2, 6, s | ||||||||||||||
| ಸ್ವರೂಪ | ಬೆಳ್ಳಿಯ ಬಿಳಿ ಬಣ್ಣ
| ||||||||||||||
| ಅಣುವಿನ ತೂಕ | 137.327 g·mol−1 | ||||||||||||||
| ಋಣವಿದ್ಯುತ್ಕಣ ಜೋಡಣೆ | [Xe] 6s2 | ||||||||||||||
| ಋಣವಿದ್ಯುತ್ ಪದರಗಳಲ್ಲಿ ಋಣವಿದ್ಯುತ್ಕಣಗಳು |
2, 8, 18, 18,8,2 | ||||||||||||||
| ಭೌತಿಕ ಗುಣಗಳು | |||||||||||||||
| ಹಂತ | ಘನ | ||||||||||||||
| ಸಾಂದ್ರತೆ (ಕೋ.ತಾ. ಹತ್ತಿರ) | 3.51 g·cm−3 | ||||||||||||||
| ದ್ರವದ ಸಾಂದ್ರತೆ at ಕ.ಬಿ. | 3.338 g·cm−3 | ||||||||||||||
| ಕರಗುವ ತಾಪಮಾನ | 1000 K (727 °C, 1341 °ಎಫ್) | ||||||||||||||
| ಕುದಿಯುವ ತಾಪಮಾನ | 2170 K (1897 °C, 3447 °F) | ||||||||||||||
| ಸಮ್ಮಿಲನದ ಉಷ್ಣಾಂಶ | 7.12 kJ·mol−1 | ||||||||||||||
| ಭಾಷ್ಪೀಕರಣ ಉಷ್ಣಾಂಶ | 140.3 kJ·mol−1 | ||||||||||||||
| ಉಷ್ಣ ಸಾಮರ್ಥ್ಯ | (25 °C) 28.07 J·mol−1·K−1 | ||||||||||||||
| |||||||||||||||
| ಅಣುವಿನ ಗುಣಗಳು | |||||||||||||||
| ಸ್ಪಟಿಕ ಸ್ವರೂಪ | cubic body centered | ||||||||||||||
| ಆಕ್ಸಿಡೀಕರಣ ಸ್ಥಿತಿಗಳು | 2 (ಬೇಸ್ ಆಕ್ಸೈಡ್) | ||||||||||||||
| ವಿದ್ಯುದೃಣತ್ವ | 0.89 (Pauling scale) | ||||||||||||||
| ಅಣುವಿನ ತ್ರಿಜ್ಯ | 215 pm | ||||||||||||||
| ಅಣುವಿನ ತ್ರಿಜ್ಯ (ಲೆಖ್ಕಿತ) | 253 pm | ||||||||||||||
| ತ್ರಿಜ್ಯ ಸಹಾಂಕ | 198 pm | ||||||||||||||
| ಇತರೆ ಗುಣಗಳು | |||||||||||||||
| ಕಾಂತೀಯ ವ್ಯವಸ್ಥೆ | paramagnetic | ||||||||||||||
| ವಿದ್ಯುತ್ ರೋಧಶೀಲತೆ | (20 °C) 332Ω·m | ||||||||||||||
| ಉಷ್ಣ ವಾಹಕತೆ | (300 K) 18.4 W·m−1·K−1 | ||||||||||||||
| ಉಷ್ಣ ವ್ಯಾಕೋಚನ | (25 °C) 20.6 µm·m−1·K−1 | ||||||||||||||
| ಯಂಗ್ ಮಾಪಾಂಕ | 13 GPa | ||||||||||||||
| ವಿರೋಧಬಲ ಮಾಪನಾಂಕ | 4.9 GPa | ||||||||||||||
| ಸಗಟು ಮಾಪನಾಂಕ | 9.6 GPa | ||||||||||||||
| ಮೋಸ್ ಗಡಸುತನ | 1.25 | ||||||||||||||
| ಸಿಎಎಸ್ ನೋಂದಾವಣೆ ಸಂಖ್ಯೆ | 7440-39-3 | ||||||||||||||
| ಉಲ್ಲೇಖನೆಗಳು | |||||||||||||||
ಬೇರಿಯಮ್ ಮೃದುವಾದ,ಭಾರವಾದ,ಬೆಳ್ಳಿಯ ಬಣ್ಣದ ಮೂಲಧಾತು ಲೋಹ.ಇದು ಬಹಳ ಸುಲಭವಾಗಿ ಬೇರೆ ವಸ್ತುಗಳೊಂದಿಗೆ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗೆ ಒಳಗಾಗುವುದರಿಂದ ಶುದ್ಧ ರೂಪದಲ್ಲಿ ದೊರೆಯುವುದಿಲ್ಲ.ಇದನ್ನು ಶುದ್ಧರೂಪದಲ್ಲಿ ಪ್ಯಾರಾಫಿನ್ ನ ತಳಭಾಗದಲ್ಲಿ ಶೇಖರಿಸುತ್ತಾರೆ.ಇದು ಪ್ರಕೃತಿಯಲ್ಲಿ ಬೇರಿಯಮ್ ಸಲ್ಫೇಟ್ ನ ರೂಪದಲ್ಲಿ ದೊರೆಯುತ್ತದೆ.ಇದನ್ನು ೧೮೦೮ರಲ್ಲಿ ಇಂಗ್ಲೆಂಡ್ ನ ಸರ್ ಹಂಫ್ರಿ ಡೇವಿ ಯವರು ಬೇರ್ಪಡಿಸಿದರು.ಇದನ್ನು ಶುದ್ಧರೂಪದಲ್ಲಿ ಉಪಯೋಗಿಸುತ್ತಿಲ್ಲವಾದರೂ, ಸಂಯುಕ್ತ ವಸ್ತುವಾಗಿ ಗಾಜಿನ ತಯಾರಿಕೆಯಲ್ಲಿ,ಅಸ್ಪತ್ರೆಗಳಲ್ಲಿ ರೋಗ ಪತ್ತೆಗೆ, ಪ್ರಯೋಗಾಲಯಗಳಲ್ಲಿ ವ್ಯಾಪಕವಾಗಿ ಉಪಯೋಗದಲ್ಲಿದೆ.ಇದು ಒಂದು ವಿಷ ವಸ್ತು.
ಬೇರಿಯಮ್
[ಬದಲಾಯಿಸಿ]ಇತಿಹಾಸ
[ಬದಲಾಯಿಸಿ]೧೬೬೦ರಲ್ಲಿ ಬೇರಿಯಮ್ ಲೋಹವನ್ನು ಪ್ರತ್ಯೇಕರಿಸಿದ ಬಾರೈಟ್ ಎಂಬ ಖನಿಜವು ಅಸಾಮಾನ್ಯ ಗುಣಗಳನ್ನು ಹೊಂದಿರುವುದು ಕಂಡುಬಂದಿತು.ನಂತರ ವಿನ್ಸೆನ್ಶಿಯಸ್ ಎಂಬ ವಿಜ್ಞಾನಿಯು, ಬೇರಿಯಮ್ ಸೂರ್ಯನ ಬೆಳಕಿಗೆ ತೆರೆದುಕೊಂಡಾಗ ಹೊಳೆಯುತ್ತದೆ ಎಂಬುದನ್ನು ಗಮನಿಸಿದರು.ಈ ಲೋಹವು ವ್ಯಾಪಕವಾಗಿ "ಬೊಲಗ್ನ ಸ್ಟೋನ್" ಎಂಬ ಹೆಸರಿನಿಂದ ಪರಿಚಿತವಾಗತೊಡಗಿತು.ಆ ಕಾಲದಲ್ಲಿ ಆಲ್ಕೆಮಿಸ್ಟ್(ರಸವಿದ್ಯಾತಜ್ಞ) ಇದರೊಂದಿಗೆ ಅನೇಕ ಪ್ರಯೋಗಗಳನ್ನು ನಡೆಸಿದರು.೧೭೭೪ರಲ್ಲಿ "ಕಾರ್ಲ್ ವಿಲ್ಹೆಮ್ ಶೀಲೆ " ಬೇರಿಯಮ್ ಸಂಯುಕ್ತವನ್ನು ಸುಣ್ಣದಿಂದ ಬೇರ್ಪಡಿಸಿದರು.ಅಂತಿಮವಾಗಿ ೧೮೦೮ರಲ್ಲಿ ಸರ್ ಹಂಫ್ರಿ ಡೇವಿ ಬೇರಿಯಮ್ ಲೋಹವನ್ನು ಕಂಡುಹಿಡಿದನು."ಹೆವಿ" ಎಂಬ ಗ್ರೀಕ್ ಪದದಿಂದ ಬೇರಿಯಮ್ ಎಂಬ ಹೆಸರು ಬಂದಿದೆ.


ಲೋಹದ ಕುರಿತು
[ಬದಲಾಯಿಸಿ]ಬೇರಿಯಮ್ ಮೃದುವಾದ, ಭಾರವಾದ ಬೆಳ್ಳಿಯ ಬಣ್ಣದ ಲೋಹ.ಇದನ್ನು ಬೇರಿಯಮ್ ಕ್ಲೋರೈಡ್ ವಿದ್ಯುದ್ವಿಭಜನೆಯ ಮೂಲಕ ತಯಾರಿಸಲಾಗಿದೆ.ಇದು ಬಹಳ ಸುಲಭವಾಗಿ ಬೇರೆ ವಸ್ತುಗಳೊಂದಿಗೆ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗೆ ಒಳಗಾಗುವುದರಿಂದ ಶುದ್ದ ರೂಪದಲ್ಲಿ ದೊರೆಯುವುದಿಲ್ಲ. ಸಾಮಾನ್ಯವಾಗಿ ಈ ಲೋಹವು ಕಾರ್ಬೋನೇಟ್ ಹಾಗು ಸಲ್ಪೇಟ್ ಅಂಶಗಳೊಂದಿಗೆ ಸೇರಿ ಕಾಣಲ್ಪಡುತ್ತದೆ.ಇದು ಭೂಮಿಯ ಹೊರ ಪದರದಲ್ಲಿನ ಬಹಳ ಹೇರಳವಾದ ಅಂಶವಾಗಿದೆ.ಶೇಕಡ ೦.೦೪೨೫% ರಷ್ಟು ಮಾತ್ರ ಭೂಮಿಯ ಹೊರಪದರದಲ್ಲಿ ಈ ಲೋಹ ಕಾಣಸಿಗುತ್ತದೆ.ಇದನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಆಮ್ಲಜನಕ ರಹಿತ ದ್ರವವಾದ ಪೆಟ್ರೋಲಿಯಂನಲ್ಲಿ ಶೇಖರಿಸಿಡಲಾಗುತ್ತದೆ.ಇದು ನೀರು ಅಥವಾ ಗಾಳಿಗೆ ತೆರೆದುಕೊಂಡಾಗ ವಿಘಟಿಸಲ್ಪಡುತ್ತದೆ.ಈ ಲೋಹದ ಅಂತ್ಯಂತ ಗಮನಾರ್ಹ ಅಂಶಗಳೆಂದರೆ ಪೆರೋಕ್ಸೈಡ್, ಕ್ಲೋರೈಡ್, ಸಲ್ಪೇಟ್, ಕಾರ್ಬೋನೇಟ್, ನೈಟ್ರೇಟ್, ಹಾಗು ಕ್ಲೋರೇಟ್. ಈ ಅಂಶಗಳ ಹೆಚ್ಚಿನ ಪ್ರಮಾಣವನ್ನು ಮಣ್ಣು, ಕಡಲಕಳೆ,ಹಾಗು ಕೆಲವು ವಿಶಿಷ್ಟ ಸಸ್ಯಗಳಲ್ಲಿ ಮಾತ್ರ ಕಾಣಬಹುದು.ಕೈಗಾರಿಕೆಗಳಲ್ಲಿ ಬೇರಿಯಮ್ ನ ವ್ಯಾಪಕವಾದ ಬಳಕೆಯಿಂದಾಗಿ ಮಾನವನ ಚಟುವಟಿಕೆಗಳು ಈ ಲೋಹವು ಪರಿಸರದಲ್ಲಿ ಹೆಚ್ಚು ಬಿಡುಗಡೆಯಾಗಲು ಕಾರಣವಾಗುತ್ತಿದೆ.ಅನೇಕ ಸ್ಥಳಗಳಲ್ಲಿ ನೈಸರ್ಗಿಕವಾಗಿ ಉಂಟಾಗುವ ಬೇರಿಯಮ್ ನ ಸಾಂದ್ರತೆ ಹೆಚ್ಚಾಗಿರುತ್ತದೆ.ಈ ಲೋಹ ಕರಗುವ ತಾಪಮಾನವು ೧೩೪೧F ಹಾಗು ಕುದಿಯುವ ತಾಪಮಾನವು ೩೪೪೭F ಆಗಿರುತ್ತದೆ." Ba" ಬೇರಿಯಮ್ ಲೋಹವನ್ನು ಪ್ರತಿನಿಧಿಸುವ ಪರಮಾಣು ಚಿಹ್ನೆಯಾಗಿದೆ.ಹಾಗು ಈ ಲೋಹದ ಪರಮಾಣು ಸಂಖ್ಯೆ, ಪರಮಾಣು ತೂಕ, ತೇವಾಂಶ ಅನುಕ್ರಮವಾಗಿ ೫೬, ೧೩೭.೩೨೭, ೦.೨% ಆಗಿರುತ್ತದೆ. ಬೇರಿಯಮ್ ನ ಆರೋಗ್ಯ ಪರಿಣಾಮಗಳು ನೀರಿನಲ್ಲಿ ಇದರ ಸಂಯುಕ್ತಗಳು ಕರಗುವುದರ ಮೇಲೆ ಅವಲಂಬಿತವಾಗಿದೆ. ನೀರಿನಲ್ಲಿ ಕರಗುವ ಬೇರಿಯಮ್ ಸಂಯುಕ್ತಗಳು ಆರೋಗ್ಯಕ್ಕೆ ಹಾನಿಕಾರಕವಾಗಿದ್ದು,ಅದು ಮಾನವನ ಉಸಿರಾಟದ ತೊಂದರೆಗಳಿಗೆ ರಕ್ತದೊತ್ತಡಕ್ಕೆ, ಹೃದಯಬಡಿತ ಬದಲಾವಣೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ.ಈ ಸಂಯುಕ್ತಗಳ ಉಸಿರಾಟದಿಂದ "ಬಾರಿಟೋಸಿಸ್" ಎಂಬ ರೋಗಕ್ಕೆ ದಾರಿಮಾಡಿಕೊಡುತ್ತದೆ.ಉತ್ಕರ್ಷಣೆಗೆ ಒಳಪಡುವ ಬೇರಿಯಮ್ ಒಂದು ಬೂದು ಬಣ್ಣದ ಲೇಪನವನ್ನು ಹೊಂದಿರುತ್ತದೆ.ಕಾಲಿಫೋರ್ನಿಯಾದ ಅಧಿಕೃತ ರತ್ನವು ಬೇರಿಯಮ್ ಒಳಗೊಂಡಿರುವ ಒಂದು ಫ್ಲೋರಸೆಂಟ್ ನೀಲಿ ರತ್ನವಾಗಿದೆ.
ಉಪಯೋಗಗಳು
[ಬದಲಾಯಿಸಿ]- ಬೇರಿಯಮ್ ನ ಆವಿಯ ಒತ್ತಡ ಕಡಿಮೆಯಾಗಿರುವುದರಿಂದ ,ಇದರ ನೋಬಲ್ ಅನಿಲಗಳನ್ನು ತೆಗೆದು ನಿರ್ವಾತ ಕೊಳವೆಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ.
- ದೇಹದ ಅಂಗಗಳನ್ನು ಎಕ್ಸರೇ ಮೇಲೆ ತೋರಿಸಲು ಸಹಾಯ ಮಾಡುವ ವಿಕಿರಣಗಳ ಕ್ರಿಯೆಯಲ್ಲಿ ಬೇರಿಯಮ್ ಪ್ರಮುಖ ಪಾತ್ರ ವಹಿಸುತ್ತದೆ.
- ಬೇರಿಯಮ್ ಕಾರ್ಬೋನೇಟ್ ಇಲಿ ವಿಷವಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ.
- ತೈಲಬಾವಿ ಕೊರೆಯುವ ದ್ರವಗಳ ತೂಕ ಪ್ರತಿನಿಧಿಗಳಾಗಿ ಬೇರಿಯಮ್ ಲೋಹವನ್ನು ಬಳಸಲಾಗುತ್ತಿದೆ.
- ಗಾಜಿನ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಬೇರಿಯಮ್ ಬಹಳ ಮುಖ್ಯವಾದ ಅಂಶವಾಗಿದೆ.
- ಲೆನಿನ್ ಸರಕುಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಬೇರಿಯಮ್ ಸಲ್ಪೇಟ್ ಬಳಸಲಾಗುತ್ತದೆ.
- ಸ್ಪಾರ್ಕ್ ಪ್ಲಗ್ ತಂತಿಗಳಲ್ಲಿ ಉಪಯೋಗಿಸುವ ಮಿಶ್ರಲೋಹವನ್ನು ತಯಾರಿಸಲು ಬೇರಿಯಮ್ ಲೋಹವನ್ನು ನಿಕಲ್(nickle) ಜೊತೆ ಬೆರೆಸಲಾಗುತ್ತದೆ.