ಆಲಿಫ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತ
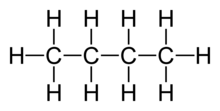

ಸಾವಯವ ರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿ ಸಂಯುಕ್ತಗಳು ಜಲಜನಕ ಮತ್ತು ಇಂಗಾಲವೆಂಬ ಮೂಲವಸ್ತುಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತವೆ. ಸಂಯುಕ್ತಗಳಲ್ಲಿ ೨ ವಿಧ:
- ಆರೋಮ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳು. ಮುಚ್ಚಿದ ಉಂಗುರಗಳನ್ನೊಳಗೊಂಡ ಸಂಯುಕ್ತಗಳು. ಸಂತೃಪ್ತ ಇಂಗಾಲ ಸಂಯುಕ್ತಗಳು. ಉದಾ: ಬೆಂಝೀನ್.
- ಆಲಿಫ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳು- ತೆರೆದ ಉಂಗುರಗಳನ್ನೊಳಗೊಂಡ ಸಂಯುಕ್ತಗಳು, ಅಸಂತೃಪ್ತ ಇಂಗಾಲ ಸಂಯುಕ್ತಗಳು. ಉದಾ:ಹೆಕ್ಸೇನ್.[೧][೨]
ಆದರೆ ಆಲಿಫ್ಯಾಟಿಕ್ (ಕೊಬ್ಬುಳ್ಳ) ಮತ್ತು ಆರೊಮ್ಯಾಟಿಕ್ (ಸುವಾಸನೆಯುಳ್ಳ) ಎಂಬ ಪದಗಳಿಗೆ ಮೊದಲಿಗೆ ಕೊಟ್ಟ ಅರ್ಥಕ್ಕೆ ಯಾವ ಮಹತ್ತ್ವವೂ ಇಂದು ಇಲ್ಲ. ಆಲಿಫ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳು ವಿವೃತಶ್ರೇಣಿ (ಓಪನ್ ಚೈನ್) ಸಂಯುಕ್ತಗಳನ್ನೂ ಇವನ್ನು ಹೋಲುವ, ಆದರೆ ಆವರ್ತರಚನೆಯುಳ್ಳ (ಸೈಕ್ಲಿಕ್ ಸ್ಟ್ರಕ್ಚರ್) ಸಂಯುಕ್ತಗಳನ್ನೂ ಒಳಗೊಂಡಿವೆ. ಈ ಸಂಯುಕ್ತಗಳು ಮುಖ್ಯವಾಗಿ ಸೇರ್ಪಡೆ (ಅಡಿಷನ್) ಮತ್ತು ಆದೇಶಕ್ರಿಯೆಗಳನ್ನು (ಸಬ್ಸ್ಟಿಟ್ಯೂಷನ್) ಅನುಸರಿಸುತ್ತವೆ. ಸೇರ್ಪಡೆಕ್ರಿಯೆ ಅಣುವಿನಲ್ಲಿ ದ್ವಿಬಂಧ ಮತ್ತು ತ್ರಿಬಂಧಗಳಿರುವೆಡೆಯಲ್ಲಿಯೂ ಆದೇಶ ಕ್ರಿಯೆಗಳು ಇತರೆಡೆಗಳಲ್ಲಿಯೂ ಜರುಗುತ್ತವೆ.
ವಿಂಗಡಣೆ
[ಬದಲಾಯಿಸಿ]ಆಲಿಫ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಮೀಥೇನ್ (CH4) ಮೊದಲನೆಯ ಸಂಯುಕ್ತ. ಉಳಿದೆಲ್ಲ ಸಂಯುಕ್ತಗಳೂ ಇದರಿಂದ ಉದ್ಭವವಾಗಿರುವುದೆಂದು ಪರಿಗಣಿಸಬಹುದು. ಹೈಡ್ರೊಕಾರ್ಬನ್ ಸಂಯುಕ್ತಗಳನ್ನು ರಾಸಾಯನಿಕ ಗುಣಗಳ ಆಧಾರದ ಮೇಲೆ 1. ಆಲ್ಕೇನ್, 2. ಆಲ್ಕೀನ್, 3. ಆಲ್ಕೈನ್, 4. ಸೈಕ್ಲಿಕ್ ಆಲಿಫ್ಯಾಟಿಕ್ ಎಂದು ವಿಂಗಡಣೆ ಮಾಡಲಾಗಿದೆ.
ಆಲ್ಕೇನ್ ಗುಂಪಿಗೆ ಸೇರಿದ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಕಾರ್ಬನ್ನಿನ ನಾಲ್ಕು ವೇಲೆನ್ಸಿಗಳೂ ಪರ್ಯಾಪ್ತ (ಸ್ಯಾಚುರೇಷನ್) ಹೊಂದಿವೆ. ಈ ಸಂಯುಕ್ತಗಳ ಹೆಸರು ಪರ್ಯಾಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ಗಳು. ಆಲ್ಕೀನ್ ಮತ್ತು ಆಲ್ಕೈನ್ಗಳಲ್ಲಿ ಕಾರ್ಬನ್ನಿನ ಪರಮಾಣುಗಳ ವೇಲೆನ್ಸಿ ಹೈಡ್ರೊಕಾರ್ಬನ್ಗಳನ್ನು ತೃಪ್ತಿಪಡಿಸುವಷ್ಟು ಹೈಡ್ರೊಜನ್ ಪರಮಾಣುಗಳಿಲ್ಲ. ಆದ್ದರಿಂದ ಅವುಗಳಿಗೆ ಅಪರ್ಯಾಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ಗಳೆಂದು ಹೆಸರಿದೆ. ಸೈಕ್ಲಿಕ್ ಹೈಡ್ರೊಕಾರ್ಬನ್ಗಳಲ್ಲಿಯೂ ಈ ಎರಡು ಬಗೆಯ ಸಂಯುಕ್ತಗಳು ಕಾಣ ಬರುತ್ತವೆ. ಇದು ಮತ್ತೊಂದು ರೀತಿಯ ವಿಂಗಡಣೆ.
ಪ್ರಮುಖ ವರ್ಗಗಳು
[ಬದಲಾಯಿಸಿ]ಆಯಾ ಗುಂಪಿಗೆ ಸೇರಿದ ಆಲಿಫ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳನ್ನು ಕಾರ್ಬನ್ನಿನ ಸಂಖ್ಯೆಗಳು ಹೆಚ್ಚುವ ರೀತಿಯಲ್ಲಿ ಜೋಡಿಸಿ ಪರೀಕ್ಷಿಸಿದರೆ ಅನುಕ್ರಮವಾದ ಅಣುಗಳ ಸೂತ್ರದಲ್ಲಿ ಒಂದು CH2 ಗುಂಪಿನ ವ್ಯತ್ಯಾಸ ಕಂಡುಬರುತ್ತದೆ. ಹಾಗೆಯೇ ಭೌತ ಮತ್ತು ರಾಸಾಯನಿಕ ಗುಣಗಳಲ್ಲಿ ಹೋಲಿಕೆಯೂ ಅನುಕ್ರಮವಾದ ವ್ಯತ್ಯಾಸಗಳೂ ಕಂಡುಬರುತ್ತವೆ. ಒಂದೇ ಶ್ರೇಣಿಗೆ ಸೇರಿದ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಈ ಗುಣಗಳಿದ್ದರೆ ಆ ಶ್ರೇಣಿಗೆ ಹೋಮಲೋಗಸ್ ಶ್ರೇಣಿಯೆಂದು ಹೆಸರು. ಮೇಲೆ ಹೇಳಿದ ಈ ಶ್ರೇಣಿಗೆ ಸೇರಿದ ಮೂರು ಸಂಯುಕ್ತಗಳನ್ನು ಆಯಾ ಶ್ರೇಣಿಗೆ ಅನ್ವಯಿಸುವಂತೆ ಒಂದು ಸರ್ವಸಾಮಾನ್ಯ ಸೂತ್ರದಿಂದ ಈ ರೀತಿ ನಿರೂಪಿಸಬಹುದು.
1. ಆಲ್ಕೇನ್ ವರ್ಗ CnH2n+2 - ಉದಾ. CH4, C2H6, C3H8
2. ಆಲ್ಕೀನ್ ವರ್ಗ CnH2n - ಉದಾ. C2H4, C3H6, C4H8
3. ಆಲ್ಕೈನ್ ವರ್ಗ CnH2n-2 - ಉದಾ. C2H2, C3H4, C4H6
ಆಲ್ಕೇನ್ಗಳು
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೇನ್ ಸಂಯುಕ್ತಗಳ ಭೌತಗುಣಗಳಲ್ಲಿ ಉಂಟಾಗುವ ಅನುಕ್ರಮವಾದ ವ್ಯತ್ಯಾಸವನ್ನು ಕುದಿಯುವ ಉಷ್ಣತೆಯಲ್ಲಿ, ಸಾಂದ್ರತೆ ಮತ್ತು ಕರಗುವ ಉಷ್ಣತೆಯಲ್ಲಿ ಕಾಣಬಹುದು. ಅಣುಕೋಶ ಹಬ್ಬಿದಂತೆಲ್ಲ ಕರಗುವ-ಕುದಿಯುವ ಉಷ್ಣತೆಯೂ ಹೆಚ್ಚುವುದು.
ಔದ್ಯೋಗಿಕವಾಗಿ ಪೆಟ್ರೋಲಿಯಂ ಮತ್ತು ಪ್ರಾಕೃತಿಕ ಅನಿಲದಿಂದ ಆಲ್ಕೇನುಗಳನ್ನು ಪಡೆಯಬಹುದು. ಅಲ್ಪಾಣುಭಾರವುಳ್ಳ ಮೀಥೇನ್ ಈಥೇನ್ ಮುಂತಾದುವು ಅನಿಲಗಳು. ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಕಾರ್ಬನ್ ಸಂಖ್ಯೆ ಹೆಚ್ಚಿದಂತೆ ಅವು ದ್ರವರೂಪದಲ್ಲಿಯೂ ಘನರೂಪದಲ್ಲಿಯೂ ಇರುತ್ತವೆ.
ಮೂರಕ್ಕಿಂತ ಹೆಚ್ಚಿರುವ ಕಾರ್ಬನ್ ಅಣುಗಳ ಸಂಯುಕ್ತಗಳು ಸಮಘಟಕಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಈ ಸಮಘಟಕಗಳಿಗೆ ಶಾಖೆಗಳಿವೆ. ಉದಾಹರಣೆ:
ಈ ಎರಡು ಘಟಕಗಳನ್ನು ಬೇರ್ಪಡಿಸಬಹುದು. ಇವುಗಳ ಭೌತ ಮತ್ತು ರಾಸಾಯನಿಕ ಗುಣಗಳಲ್ಲಿ ವ್ಯತ್ಯಾಸವಿದೆ.
ಆಲ್ಕೇನ್ ಗುಂಪಿನ ಸಂಯುಕ್ತಗಳು ಪರ್ಯಾಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳಾಗಿರುವುದರಿಂದ ರಾಸಾಯನಿಕ ಕ್ರಿಯಾ ದೃಷ್ಟಿಯಿಂದ ಅವನ್ನು ಜಡಪದಾರ್ಥಗಳೆನ್ನಬಹುದು. C-H ಅಥವಾ C-C ಬಂಧಗಳು ಸಾಮಾನ್ಯ ಉಷ್ಣತೆಯಲ್ಲಿ ಪ್ರಬಲ ಆಮ್ಲ, ಬ್ರೋಮಿನ್ (ಕತ್ತಲಲ್ಲಿ) ಮತ್ತು ಆಕ್ಸಿಜನ್ಗಳಿಂದ ಉತ್ಕರ್ಷಣ ಹೊಂದುವುದಿಲ್ಲ. ಹೆಚ್ಚಿನ ಉಷ್ಣತೆಯಲ್ಲಿ ಈ ಸಂಯುಕ್ತಗಳು ಉರಿದು ಗಾಳಿಯ ಆಕ್ಸಿಜನ್ನಿನೊಂದಿಗೆ ಸೇರಿ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಮತ್ತು ನೀರಿನ ಅಣುಗಳಾಗಿ ಪರಿವರ್ತನೆ ಹೊಂದುತ್ತವೆ. ಪೆಟ್ರೋಲಿಯಂನಿಂದ ಒದಗುವ ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳನ್ನು ಅಗಾಧ ಪ್ರಮಾಣದಲ್ಲಿ ಇಂಧನಗಳಾಗಿ ಉಪಯೋಗಿಸುತ್ತಾರೆ.
ಆಲ್ಕೀನ್ಗಳು
[ಬದಲಾಯಿಸಿ]ಇವು ಅಪರ್ಯಾಪ್ತ ಹೈಡ್ರೊಕಾರ್ಬನ್ನುಗಳು. ಎಥಿಲೀನ್ ಈ ಗುಂಪಿನ ಮಾದರಿ. ಭೌತಗುಣಗಳಲ್ಲಿ ಆಲ್ಕೇನುಗಳನ್ನು ಹೋಲುತ್ತವೆ. ಈ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಕಾರ್ಬನ್ನುಗಳ ಸಂಯೋಜನ ಶಕ್ತಿಯನ್ನು ತೃಪ್ತಿಪಡಿಸುವಷ್ಟು ಹೈಡ್ರೊಜನ್ ಅಣುಗಳಿಲ್ಲವಾದ್ದರಿಂದ ಕಾರ್ಬನ್ನುಗಳ ನಡುವೆ ದ್ವಿಬಂಧವೇರ್ಪಡುತ್ತದೆ. ಈ ದ್ವಿಬಂಧವನ್ನು ಅತಿರಕ್ತರೋಹಿತದಲ್ಲಿ ಸುಲಭವಾಗಿ ಗುರುತಿಸಬಹುದು. ಸಾಮಾನ್ಯವಾಗಿ ಏಕಬಂಧದಿಂದ (C-C) ಸೇರಿರುವ ಕಾರ್ಬನ್ ಪರಮಾಣುಗಳಿಗೆ ಆ ಬಂಧದ ಸುತ್ತ ಭ್ರಮಿಸುವ ಸ್ವಾತಂತ್ರ್ಯವಿದೆ (ಫ್ರೀ ರೊಟೇಷನ್). ದ್ವಿಬಂಧಗಳಿದ್ದರೆ ಈ ಸ್ವಾತಂತ್ರ್ಯ ಮೊಟಕಾಗುತ್ತದೆ. ದ್ವಿಬಂಧದಿಂದ ಸೇರ್ಪಟ್ಟಿರುವ ಕಾರ್ಬನ್ನುಗಳಿಗೆ ಅನುಗುಣವಾದ ಗುಂಪುಗಳನ್ನು ಹೈಡ್ರೊಜನ್ನಿನ ಬದಲಿಗೆ ಸೇರಿಸಿದರೆ ಎರಡು ಸಮಘಟಕಗಳು ಉತ್ಪತ್ತಿಯಾಗುವುವು.
ಸಾಮಾನ್ಯವಾಗಿ ಟ್ರಾನ್ಸ್ಘಟಕ, ಸಿಸ್ಘಟಕ ಸಂಯುಕ್ತಗಳಿಗಿಂತ ಹೆಚ್ಚು ಸ್ಥಿರವಾಗಿವೆ. ಆಲ್ಕೀನುಗಳಲ್ಲಿ ದ್ವಿಬಂಧವಿರುವುದರಿಂದ ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳು ಬಲುಮಟ್ಟಿಗೆ ಆ ಎಡೆಯಲ್ಲಿ ನಡೆಯುತ್ತವೆ. ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಕ್ರಿಯೆಗೆ ಕಾರಣವಾದ ಗುಂಪುಗಳ ಹೆಸರು ಸಕ್ರಿಯಾ ಪುಂಜಗಳು (ಫಂಕ್ಷನಲ್ ಗ್ರೂಪ್ಸ್). ಸಿಗ್ಮ ಮತ್ತು ಪೈ ಬಂಧಗಳನ್ನೊಳಗೊಂಡ ದ್ವಿಬಂಧದಲ್ಲಿ, ಪೈ ಬಂಧ ದುರ್ಬಲವಾಗಿರುವ ಕಾರಣ ಸೇರ್ಪಡೆ ಕ್ರಿಯೆಗಳು ಬಂಧದ ಛೇದನೆಯಿಂದ ಜರಗುತ್ತವೆ.
ಆಲ್ಕೀನ್ಗಳು ಸೇರ್ಪಡೆ ಹೊಂದುತ್ತವೆ ಮತ್ತು ಆದೇಶಕ್ರಿಯೆಗಳನ್ನು ಜರುಗಿಸುತ್ತವೆ. ಅಲ್ಲದೆ ಇನ್ನೊಂದು ಸರ್ವಸಾಮಾನ್ಯ ಕ್ರಿಯೆಗೆ ಒಳಗಾಗುತ್ತವೆ. ಈ ಕ್ರಿಯೆಯಲ್ಲಿ ದ್ವಿಬಂಧ ಪೂರ್ಣವಾಗಿ ಮುರಿದು ಎರಡು ಅಲ್ಪತರ ಅಣುಗಳು ಉತ್ಪತ್ತಿಯಾಗುವುವು. ದ್ವಿಬಂಧಗಳನ್ನು ಛೇದಿಸಲು ಸಾಮಾನ್ಯವಾಗಿ ಓಜ಼ೋನನ್ನು ಉಪಯೋಗಿಸಲಾಗುತ್ತದೆ. ಓಜ಼ೋನ್ಛೇದನ ಎರಡು ಹಂತದಲ್ಲಿ ನಡೆಯುತ್ತದೆ. ಇಲ್ಲಿ ಉತ್ಪತ್ತಿಯಾಗುವ ಆಲ್ಡಿಹೈಡ್ ಮತ್ತು ಕೀಟೋನ್ಗಳ ರಚನೆಯನ್ನೂ ಹೈಡ್ರೊಕಾರ್ಬನ್ನಿನ ರಚನೆಯನ್ನೂ ಕಂಡುಹಿಡಿಯಬಹುದು.
ಆಲ್ಕೈನ್ಗಳು ಮತ್ತು ಡಯೀನ್ಗಳು
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೈನ್ ಮತ್ತು ಡಯೀನ್ಗಳ ಗುಂಪಿನ ಸಾಮಾನ್ಯ ಸೂತ್ರ CnH2n-2. ಈ ಗುಂಪಿನ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಹೈಡ್ರೊಜನ್ ಪ್ರಮಾಣ ಆಲ್ಕೀನ್ಗಳಿಗಿಂತ ತಗ್ಗಿದೆ. ಆದ್ದರಿಂದ ಅತೃಪ್ತತೆ ಇನ್ನಷ್ಟು ಹೆಚ್ಚು. ಇವೆರಡು ಗುಂಪುಗಳ ಸಾಮಾನ್ಯ ಸೂತ್ರ ಒಂದೇ ಆದರೂ ಸಕ್ರಿಯಾ ಗುಂಪುಗಳು ಬೇರೆಯಾಗಿರುವುದರಿಂದ ಅವುಗಳ ಗುಣಗಳು ಭಿನ್ನವಾಗಿವೆ.
ಆಲ್ಕೈನ್ಗಳು
[ಬದಲಾಯಿಸಿ]ಅಸಿಟಲಿನ್ (C2H2) ಈ ಗುಂಪಿನ ಸರಳ ಪ್ರತಿನಿಧಿ. ಕಾರ್ಬನ್-ಕಾರ್ಬನ್ಗಳ ನಡುವೆ ತ್ರಿಬಂಧವಿದೆ. ಇವುಗಳ ಪೈಕಿ ಒಂದು H-C≡C-H ಸಿಗ್ಮ ಮತ್ತು ಇನ್ನೆರಡು ಪೈ ಬಂಧಗಳು. ಅಸಿಟಲಿನ್ ನೀಳವಾದ ಅಣುವಾದ್ದರಿಂದ ಪೈ ಬಂಧಗಳ ಎಲೆಕ್ಟ್ರಾನ್ ಮೇಘಗಳು ಸಿಲಿಂಡರ್ (ಕೊಳವೆ) ಆಕೃತಿಯಲ್ಲಿರುತ್ತವೆಂದು ಗೊತ್ತಾಗಿದೆ.
ಆಲ್ಕೈನ್ಗಳ ಭೌತಗುಣಗಳು ಆಲ್ಕೇನ್ ಮತ್ತು ಆಲ್ಕೀನ್ ಸಂಯುಕ್ತದಂತೆಯೇ ಇವೆ.
ಅಸಿಟಲಿನ್ ಮತ್ತು ಆಲ್ಕೈನ್ಗಳು ಸೇರ್ಪಡೆ ಕ್ರಿಯೆಗಳಿಗೆ ಸುಲಭವಾಗಿ ಒಳಗಾಗುತ್ತವೆ.
ಡಯೀನ್ಗಳು
[ಬದಲಾಯಿಸಿ]ಈ ಸಂಯುಕ್ತಗಳು ಎರಡು ದ್ವಿಬಂಧಗಳಿರುವ ಸರಳ ಆಲ್ಕೀನ್ಗಳು. ಆದ್ದರಿಂದ ಆಲ್ಕೀನ್ಗಳಿಗಿರುವ ಗುಣಗಳೇ ಇವೆ. ಆದರೆ ಕೆಲವು ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಈ ಗುಣಗಳು ಸ್ವಲ್ಪಮಟ್ಟಿಗೆ ಬದಲಾವಣೆ ಹೊಂದಿವೆ.
ಡಯೀನ್ಗಳನ್ನು ಸುಲಭವಾಗಿ ಎರಡು ಗುಂಪುಗಳನ್ನಾಗಿ ವಿಭಾಗಿಸಿದೆ.
- ಎರಡು ದ್ವಿಬಂಧಗಳ ನಡುವೆ ಒಂದು ಏಕಬಂಧವಿರುವ ಪರ್ಯಾಯ (ಕಾಂಜ್ಯುಗೇಟೆಡ್) ಸಂಯುಕ್ತಗಳು.
- ಅನೇಕ ಏಕಬಂಧಗಳಿಂದ ಪ್ರತ್ಯೇಕಿಸಲ್ಪಟ್ಟ ದ್ವಿಬಂಧಗಳುಳ್ಳ ಸಂಯುಕ್ತಗಳು (ಪ್ರತ್ಯೇಕಿತ ದ್ವಿಬಂಧಗಳು).
| | | | | | | | | |
-C=C-C=C- -C=C-C-C-C=C-
| | | |
ಪರ್ಯಾಯ ದ್ವಿಬಂಧಗಳು ಪ್ರತ್ಯೇಕಿತ ದ್ವಿಬಂಧಗಳು
ಅಷ್ಟು ಮುಖ್ಯವಲ್ಲದ ಮೂರನೆಯ ಗುಂಪೂ ಉಂಟು. ಈ ಗುಂಪಿನ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ದ್ವಿಬಂಧಗಳು ಪಕ್ಕದಲ್ಲಿರುತ್ತವೆ. ಇದಕ್ಕೆ ಅಲ್ಲೀನ್ಸ್ ಎಂದು ಹೆಸರು.
| |
-C=C=C-
ಡಯೀನ್ಗಳ ರಾಸಾಯನಿಕ ಗುಣಗಳು ದ್ವಿಬಂಧಗಳ ಜೋಡಣೆಯನ್ನು ಅವಲಂಬಿಸಿದೆ. ಪ್ರತ್ಯೇಕಿಸಲ್ಪಟ್ಟ ದ್ವಿಬಂಧಗಳು ಸ್ವತಂತ್ರವಾಗಿ ಪರಸ್ಪರವಾಗಿ ಯಾವ ಸಂಬಂಧವಿಲ್ಲದಂತೆ ವರ್ತಿಸುತ್ತವೆ. ಆದ್ದರಿಂದ ಇವುಗಳ ಗುಣಗಳು ಆಲ್ಕೀನ್ಗಳನ್ನು ಬಲುಮಟ್ಟಿಗೆ ಹೋಲುತ್ತವೆ. ಆದರೆ ಪರ್ಯಾಯದ್ವಿಬಂಧವುಳ್ಳ ಡಯೀನ್ಗಳಿಗೂ ಆಲ್ಕೀನ್ಗಳಿಗೂ ಮುಖ್ಯವಾದ ಮೂರು ವ್ಯತ್ಯಾಸಗಳಿವೆ.
- ಡಯೀನ್ಗಳ ಸ್ಥಿರತೆ.
- ಸೇರ್ಪಡೆ 1,4 ಕಾರ್ಬನ್ಗಳಲ್ಲಿ ನಡೆಯುತ್ತದೆ; (1,4 ಅಡಿಷನ್).
- ಕ್ರಿಯಾ ಚಟುವಟಿಕೆ ಅಧಿಕ.
1,4 ಸೇರ್ಪಡೆ: 1,4 ಪೆಂಟಾಡಯೀನಿಗೆ ಡೈ ಆಲ್ಡಿಹೈಡ್ ಉತ್ಪತ್ತಿಯಾಗುವ ಪರಿಸ್ಥಿತಿಯಲ್ಲಿ, ಬ್ರೋಮಿನನ್ನು ಸೇರಿಸಿದರೆ 4,5 ಡೈಬ್ರೋಮೊ (ಎರಡು ಬ್ರೋಮಿನ್ಗಳು) 1-ಪೆಂಟೇನ್ ಉತ್ಪತ್ತಿಯಾಗುವುದು. ಮತ್ತಷ್ಟು ಬ್ರೋಮಿನನ್ನು ಸೇರಿಸಿದರೆ 1,2,4,5, ಟೆಟ್ರಾ (ನಾಲ್ಕು)ಬ್ರೋಮೊ ಪೆಂಟೇನ್ ಉತ್ಪತ್ತಿಯಾಗುವುದು.
H2C=CH-CH2-CH=CH2 + Br2 → CH2-CH-CH2-CH=CH2 + Br2 → CH2-CH-CH2-CH-CH2
| | | | | |
Br Br Br Br Br Br
1,4 ಪೆಂಟಾಡಯೀನ್ 4,5 ಡೈಬ್ರೋಮೊ 1-ಪೆಂಟೇನ್ 1,2,4,5 ಟೆಟ್ರಬ್ರೋಮೊ ಪೆಂಟೇನ್
ಪ್ರತ್ಯೇಕಿತ ದ್ವಿಬಂಧಗಳಿರುವ ಡಯೀನ್ಗಳಲ್ಲಿ ಸೇರ್ಪಡೆ ಈ ಮಾದರಿಯಲ್ಲಿಯೇ ನಡೆಯುವುದು. ಎರಡು ದ್ವಿಬಂಧಗಳೂ ಸ್ವತಂತ್ರವಾಗಿ ವರ್ತಿಸುತ್ತವೆ. ಆದರೆ 1,3 ಬ್ಯೂಟಾಡಯೀನ್ ಸಂಯುಕ್ತಕ್ಕೆ ಬ್ರೋಮಿನ್ ಸೇರಿಸಿದರೆ ನಿರೀಕ್ಷಿತವಾದ 3,4 ಡೈಬ್ರೋಮೊ 1-ಬ್ಯೂಟೇನ್ ಮಾತ್ರವಲ್ಲದೆ 1,4 ಡೈಬ್ರೋಮೊ 2-ಬ್ಯೂಟೇನ್ ಸಹ ಉತ್ಪತ್ತಿಯಾಗುವುದು.
CH2-CH-CH=CH2
| |
Br Br
CH2=CH-CH=CH2 + Br2 → 1,2 ಸೇರ್ಪಡೆ
CH2-CH=CH-CH2
| |
Br Br
ಈ ಎರಡು ಫಲಿತಗಳ ಪ್ರಮಾಣ ಕ್ರಿಯೆ ನಡೆಯುವ ಉಷ್ಣತೆಯನ್ನು ಅವಲಂಬಿಸಿದೆ.
ಬಹ್ವಂಗೀಕರಣ (ಪಾಲಿಮರೈಸೇಷನ್)
[ಬದಲಾಯಿಸಿ]ಆಲ್ಕೀನ್ ಮತ್ತು ಡಯೀನ್ಗಳು ಔದ್ಯೋಗಿಕವಾಗಿ ಬಲುಮುಖ್ಯವಾದ ಬಹ್ವಂಗೀಕರಣ ಕ್ರಿಯೆಗೆ ಒಳಪಡುತ್ತವೆ. ಉದಾಹರಣೆಗೆ, ಎಥಿಲೀನನ್ನು ಆಕ್ಸಿಜನ್ ವಾತಾವರಣದಲ್ಲಿ ಹೆಚ್ಚು ಸಂಮರ್ದದಲ್ಲಿ ಕಾಯಿಸಿದಾಗ ಅಧಿಕ ಅಣುಬಾರವಿರುವ (ಸುಮಾರು 20,000) ಪಾಲಿಎಥಿಲೀನ್ ಎಂಬ ಉದ್ದವಾದ ಆಲ್ಕೇನ್ ಉತ್ಪತ್ತಿಯಾಗುತ್ತದೆ.
ಉಷ್ಣ, ಸಂಮರ್ದ
ಅನೇಕ ಅಲ್ಪಪ್ರಮಾಣದ ಅಣುಗಳು ಕೂಡಿ ಮಹದಣುಗಳನ್ನು ಉತ್ಪತ್ತಿಸುವ ಕ್ರಿಯೆಗೆ ಬಹ್ವಂಗೀಕರಣ ಎನ್ನಬಹುದು. ಈ ಕ್ರಿಯೆಯ ಆಧಾರದಿಂದ ಪ್ಲಾಸ್ಟಿಕ್, ಕೃತಕ ರಬ್ಬರ್ ಇತ್ಯಾದಿ ಬಹ್ವಣುಗಳನ್ನು ತಯಾರಿಸುತ್ತಾರೆ.
ಇತರ ಆಲಿಫ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳು
[ಬದಲಾಯಿಸಿ]ಕಾರ್ಬನ್ ಮತ್ತು ಹೈಡ್ರೊಜನ್ಗಳ ಜೊತೆಗೆ ಆಕ್ಸಿಜನ್, ಫಾಸ್ಫರಸ್, ನೈಟ್ರೊಜನ್ ಮೂಲವಸ್ತುಗಳನ್ನೊಳಗೊಂಡ ಅನೇಕಾನೇಕ ಸಂಯುಕ್ತಗಳು ರಚಿತವಾಗುತ್ತವೆ. ಈ ಸಂಯುಕ್ತಗಳನ್ನು ಅವುಗಳಲ್ಲಿನ ಸಕ್ರಿಯ ಗುಂಪಿನ ಆಧಾರದ ಮೇಲೆ ಕೆಳಗೆ ಕಂಡಂತೆ ವಿಭಾಗಿಸಬಹುದು. ಈ ನಾನಾ ಸಂಯುಕ್ತಗಳ ರಾಸಾಯನಿಕಗುಣಗಳು ಅವುಗಳಲ್ಲಿನ ಸಕ್ರಿಯ ಗುಂಪಿನ ಗುಣಗಳನ್ನವಲಂಬಿಸಿವೆ.
1. (−OH) ಗುಂಪನ್ನುಳ್ಳ ಆಲ್ಕೊಹಾಲ್ಗಳು: ಮೀಥೈಲ್ ಆಲ್ಕೊಹಾಲ್, ಈಥೈಲ್ ಆಲ್ಕೊಹಾಲ್ ಈ ಸಂಯುಕ್ತಗಳು ಉತ್ಕರ್ಷಣ ಹೊಂದಿ ಆಲ್ಡಿಹೈಡ್ ಅಥವಾ ಕೀಟೋನ್ಗಳಾಗಿ ಪರಿವರ್ತನೆಯಾಗುತ್ತವೆ. ಆಮ್ಲಗಳೊಂದಿಗೆ ಎಸ್ಟರ್ಗಳನ್ನು ಉಂಟುಮಾಡುತ್ತವೆ. ಅನೇಕ (OH) ಪುಂಜವುಳ್ಳ ಆಲ್ಕೊಹಾಲ್ಗಳು ಸಿಹಿಯಾಗಿದ್ದು ಸಕ್ಕರೆಗಳ ರೂಪದಲ್ಲಿ ದೊರೆಯುತ್ತವೆ.
2. (−SH) ಥೈಯಾಲ್ ಗುಂಪುಳ್ಳ ಮರ್ಕ್ಯಾಪ್ಟಾನ್ಗಳು. ಇವು ಆಲ್ಕೊಹಾಲ್ಗಳನ್ನು ಹೋಲುತ್ತವೆ.
3. (−CHO) ಆಲ್ಡಿಹೈಡ್ಗಳು: ಆಲ್ಡಿಹೈಡ್ಗಳು ಅಪಕರ್ಷಣಕಾರಿಗಳು. ಈ ಗುಣದಿಂದ ಅವನ್ನು ಕಂಡುಹಿಡಿಯಬಹುದು. ಉದಾಹರಣೆಗೆ ಅಸಿಟಾಲ್ಡಿಹೈಡ್ ಉತ್ಕರ್ಷಣಹೊಂದಿ ಆಮ್ಲಗಳಿಗೆ ಪರಿವರ್ತನೆ ಹೊಂದುತ್ತದೆ.
4. (−CO) ಕೀಟೋನ್ಗಳು: ರಾಸಾಯನಿಕ ಗುಣಗಳು ಆಲ್ಡಿಹೈಡನ್ನು ಹೋಲುತ್ತವೆ.
5. (−COOH) ಕಾರ್ಬಾಕ್ಸಿಲ್ಗಳು: ಈ ಗುಂಪುಳ್ಳ ಸಂಯುಕ್ತಗಳು ಆಮ್ಲಗಳಂತೆ ವರ್ತಿಸುತ್ತವೆ. ಆದರೆ ನೀರಿನಲ್ಲಿ ಹೆಚ್ಚಿಗೆ ಅಯಾನಿಸುವುದಿಲ್ಲ. ಅಮೈಡ್ (-CONH2) ಮತ್ತು ಎಸ್ಟರ್ಗಳನ್ನು ಉತ್ಪಾದಿಸುತ್ತವೆ.
6. (−NH2) ಅಮೀನ್ಗಳು: ಅಮೀನ್ಗಳನ್ನು ಪ್ರೈಮರಿ, ಸೆಕೆಂಡರಿ, ಟರ್ಷಿಯರಿ ಎಂಬ ಗುಂಪುಗಳನ್ನಾಗಿ ವಿಭಾಗಿಸಲಾಗಿದೆ. ನೈಟ್ರೊಜನ್ ಅಣುವಿಗೆ ಸೇರಿರುವ ಗುಂಪುಗಳ ಆಧಾರದ ಮೇಲೆ ಈ ವಿಭಾಗ ಮಾಡಲಾಗಿದೆ.
H H R
| | |
R-N-H R-N-R R-N-R
ಪ್ರೈಮರಿ ಸೆಕೆಂಡರಿ ಟರ್ಷಿಯರಿ
ಈ ಸಂಯುಕ್ತಗಳ ಮುಖ್ಯ ಗುಣ ಪ್ರತ್ಯಾಮ್ಲತೆ. ಮಿಕ್ಕೆಲ್ಲ ಗುಣಗಳೂ ಈ ಗುಣದಿಂದ ಉದ್ಭವವಾಗುತ್ತವೆ ಎನ್ನಬಹುದು.
ಉದಾಹರಣೆಗೆ ಮೀಥೈಲ್ ಅಮೀನ್ (ಪ್ರೈಮರಿ), ಡೈಮೀಥೈಲ್ ಅಮೀನ್ (ಸೆಕೆಂಡರಿ) ಮತ್ತು ಟ್ರೈಮೀಥೈಲ್ ಅಮೀನ್ (ಟರ್ಷಿಯರಿ).
7. R-O-R'- ಈಥರ್ಗಳು: ಎರಡು ಆಲ್ಕೊಹಾಲ್ ಅಣುಗಳು ನೀರಿನ ಒಂದು ಅಣುವಿನ ಬಿಡುಗಡೆಯ ಮೂಲಕ ಸೇರ್ಪಡೆಯಾದಾಗ ಈಥರ್ಗಳು ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ.
RCH2OH + R'CH2OH → R-CH2OCH2-R' + H2O
ಈಥರ್
ಈಥರ್ಗಳು ಸಾಮಾನ್ಯವಾಗಿ ರಾಸಾಯನಿಕ ದೃಷ್ಟಿಯಿಂದ ಜಡಪದಾರ್ಥಗಳು. ಉದಾಹರಣೆಗೆ, ಈಥೈಲ್ ಈಥರ್.
8. ಎಸ್ಟರ್ಗಳು (R-COOR'): ಆಲ್ಕೊಹಾಲ್ ಅಣು ಮತ್ತು ಸಾವಯವ ಆಮ್ಲಗಳು ನೀರಿನ ಒಂದು ಅಣುವಿನ ಬೇರ್ಪಡೆಯಿಂದ ಸಂಯೋಜಿತವಾದಾಗ ಎಸ್ಟರ್ಗಳು ತಯಾರಾಗುತ್ತವೆ. ಇವು ಸುವಾಸನೆಯುಳ್ಳ ವಸ್ತುಗಳು. ಉದಾಹರಣೆಗೆ ಈಥೈಲ್ ಅಸಿಟೇಟ್.
9. ಹ್ಯಾಲೈಡ್ಗಳು (R-X): ಆಲ್ಕೇನ್, ಆಲ್ಕೀನ್ ಅಥವಾ ಆಲ್ಕೈನ್ ಸಂಯುಕ್ತಗಳೊಂದಿಗೆ ಹ್ಯಾಲೊಜಿನ್ ಮೂಲವಸ್ತುಗಳು ವರ್ತಿಸಿದಾಗ ಅನೇಕ ತರಹೆಯ ಆಲ್ಕೈಲ್ ಹ್ಯಾಲೈಡ್ಗಳು ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ. ಈ ಸಂಯುಕ್ತಗಳು ಬಹಳ ದುರ್ಬಲವಾದ ಪ್ರತ್ಯಾಮ್ಲಗಳಂತೆ ವರ್ತಿಸುತ್ತವೆ. ಅತಿ ಚಟುವಟಿಕೆಯುಳ್ಳ ವಸ್ತುಗಳಾದ್ದರಿಂದ ಅನೇಕ ತರಹೆಯ ಕ್ರಿಯೆಗಳಿಗೆ ಒಳಗಾಗುತ್ತವೆ. ಉದಾಹರಣೆಗೆ ಮೀಥೈಲ್ ಕ್ಲೋರೈಡ್ ಕ್ಲೋರೊಫಾರ್ಮ್ ಇತ್ಯಾದಿ.
ಆಲಿಫ್ಯಾಟಿಕ್ ಸಂಯುಕ್ತಗಳ ಉದಾಹರಣೆಗಳು
[ಬದಲಾಯಿಸಿ]| ಸೂತ್ರ | ಹೆಸರು | ಸಿ.ಎ.ಎಸ್. ಸಂಖ್ಯೆ | ರಚನಾತ್ಮಕ ಸೂತ್ರ | - |
|---|---|---|---|---|
| CH4 | ಮೀಥೇನ್ | 74-82-8 | 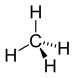 |
ಆಲ್ಕೇನ್ |
| C2H2 | ಈಥೈನ್ | 74-86-2 | ಆಲ್ಕೈನ್ | |
| C2H4 | ಈಥೀನ್ | 74-85-1 | 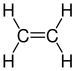 |
ಆಲ್ಕೀನ್ |
| C2H6 | ಈಥೇನ್ | 74-84-0 |  |
ಆಲ್ಕೇನ್ |
| C3H4 | ಪ್ರೊಪೈನ್ | 74-99-7 | ಆಲ್ಕೈನ್ | |
| C3H6 | ಪ್ರೊಪೀನ್ | - | 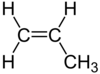 |
ಆಲ್ಕೀನ್ |
| C3H8 | ಪ್ರೊಪೇನ್ | - |  |
ಆಲ್ಕೇನ್ |
| C4H6 | 1,3-2-ಬ್ಯುಟಡಯೀನ್ | 590-19-2 |  |
ಡಯೀನ್ |
| C4H6 | 1-ಬ್ಯಟೈನ್ | - |  |
ಆಲ್ಕೈನ್ |
| C4H8 | ಬ್ಯುಟೀನ್ | - | e.g.  |
ಆಲ್ಕೀನ್ |
| C4H10 | ಬುಟೇನ್ | - | 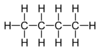 |
ಆಲ್ಕೇನ್ |
| C6H10 | ಸೈಕ್ಲೋಹೆಕ್ಸೇನ್ | 110-83-8 | ಸೈಕ್ಲೋಆಲ್ಕೀನ್ | |
| C5H12 | ''n''-ಪೆಂಟೇನ್ | 109-66-0 | ಆಲ್ಕೇನ್ | |
| C7H14 | ಸೈಕ್ಲೋಪೆಂಟೇನ್ | 291-64-5 | ಸೈಕ್ಲೋಆಲ್ಕೇನ್ | |
| C7H14 | ಮಿಥೈಲ್ ಸೈಕ್ಲೋಹೆಕ್ಸೇನ್ | 108-87-2 | 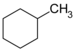 |
ಸೈಕ್ಲೋಹೆಕ್ಸೇನ್ |
| C8H8 | ಕ್ಯುಬೇನ್ | 277-10-1 |  |
ಸೈಕ್ಲೋಬ್ಯುಟೇನ್ |
| C9H20 | ನೊನೇನ್ | 111-84-2 | ಆಲ್ಕೇನ್ | |
| C10H12 | ಡೈಸೈಕ್ಲೋಪೆಂಟಡಯೀನ್ | 77-73-6 |  |
ಡಯೀನ್ ಸೈಕ್ಲೋಆಲ್ಕೀನ್ |
| C10H16 | ಫೆಲ್ಲಾನ್ಡ್ರೀನ್ | 99-83-2 | 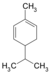  |
ಟರ್ಪೀನ್, ಡಯೀನ್ ಸೈಕ್ಲೋಆಲ್ಕೀನ್ |
| C10H16 | α-ಟರ್ಪನೀನ್ | 99-86-5 | T, ಟರ್ಪೀನ್. ಡಯೀನ್ ಸೈಕ್ಲೋಆಲ್ಕೀನ್ | |
| C10H16 | ಲಿಮೊನೀನ್ | 5989-27-5 |  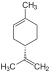 |
ಟರ್ಪೀನ್. ಡಯೀನ್ ಸೈಕ್ಲೋಆಲ್ಕೀನ್ |
| C11H24 | ಅನ್ ಡಿಕೇನ್ | 1120-21-4 | ಆಲ್ಕೇನ್ | |
| C30H50 | ಸ್ಕ್ವಲೀನ್ | 111-02-4 | ಟರ್ಪೀನ್ ,ಪೊಲಿಯಿನ್ | |
| C2nH4n | ಪಾಲಿಥಲೀನ್ | 9002-88-4 | ಆಲ್ಕೇನ್ |
ಉಲ್ಲೇಖಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ Britannica, The Editors of Encyclopaedia. "aliphatic compound". Encyclopedia Britannica, 10 Jan. 2019, https://www.britannica.com/science/aliphatic-compound. Accessed 22 March 2023.
- ↑ https://www.sciencedirect.com/topics/chemistry/aliphatic-compound

- Articles with BNF identifiers
- Pages with authority control identifiers needing attention
- Articles with BNFdata identifiers
- Articles with J9U identifiers
- Articles with LCCN identifiers
- Articles with NDL identifiers
- ರಸಾಯನಶಾಸ್ತ್ರ
- ಹೈಡ್ರೋ ಕಾರ್ಬನ್ ರಸಾಯನ ಶಾಸ್ತ್ರ
- ಮೈಸೂರು ವಿಶ್ವವಿದ್ಯಾನಿಲಯ ವಿಶ್ವಕೋಶ
- Pages that use a deprecated format of the chem tags






![{\displaystyle {\ce {nCH2=CH2->[O_{2}]\sim (CH2-CH2-CH2)_{n}\sim }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/55cb1d7fb6c872522b18968431baffc6b6d0bc99)