ಪ್ರತಿಕಾಯ(ಆಂಟಿಬಾಡಿ)
ಪ್ರತಿಕಾಯಗಳು (ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್(ಪ್ರತಿರಕ್ಷಣಾ ಗ್ಲಾಬ್ಯುಲಿನ್) ಗಳೆಂದೂ[೧] ಕರೆಯಲಾಗುತ್ತದೆ, ಸಂಕ್ಷಿಪ್ತವಾಗಿ Ig ) ಗ್ಯಾಮ ಗ್ಲಾಬ್ಯುಲಿನ್ ಪ್ರೋಟೀನ್ಗಳಾಗಿವೆ. ಅವು ಕಶೇರುಕಗಳ ರಕ್ತ ಅಥವಾ ಇತರ ಶಾರೀರಿಕ ದ್ರವಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ. ಅವುಗಳನ್ನು ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯು ಬ್ಯಾಕ್ಟೀರಿಯಾಾ ಮತ್ತು ವೈರಸ್ಗಳಂತಹ ಬಾಹ್ಯ ವಸ್ತುಗಳನ್ನು ಗುರುತಿಸಲು ಮತ್ತು ತಟಸ್ಥಗೊಳಿಸಲು ಬಳಸಿಕೊಳ್ಳಲಾಗುತ್ತದೆ. ಅವು ವೈಶಿಷ್ಟ್ಯವಾಗಿ ಮೂಲ ರಚನಾತ್ಮಕ ಘಟಕಗಳಿಂದ ರಚಿಸಲ್ಪಟ್ಟಿರುತ್ತವೆ - ಪ್ರತಿಯೊಂದು ಎರಡು ದೊಡ್ಡ ದೀರ್ಘ ಸರಪಣಿ(ಗಳು ಮತ್ತು ಎರಡು ಸಣ್ಣ ಸರಳ ಸರಪಣಿಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಉದಾಹರಣೆಗಾಗಿ,(ಅಣುವಿನಲ್ಲಿರುವ ಘಟಕ) ಮಾನೊಮರ್ಗಳು ಒಂದು ಘಟಕದಿಂದ,(ಎರಡು ಅಣುಗಳಿಂದ ಉಂಟಾದ ಒಂದೇ ಅಣು) ಡೈಮರ್ಗಳು ಎರಡು ಘಟಕಗಳಿಂದ ಅಥವಾ(ಐದು ಘಟಕಗಳ ಕಾಯ,ಪ್ರತಿಕಾಯದ ಅಂಶ ಇರುವಂತಹದ್ದು) ಪೆಂಟಾಮರ್ಗಳು ಐದು ಘಟಕಗಳಿಂದ ಮಾಡಲ್ಪಟ್ಟಿರುತ್ತವೆ. ಪ್ರತಿಕಾಯಗಳು ಪ್ಲಾಸ್ಮಾ ಜೀವಕೋಶಗಳೆನ್ನುವ ಒಂದು ರೀತಿಯ ಬಿಳಿ ರಕ್ತಕಣದಿಂದ ಉತ್ಪಾದಿಸಲ್ಪಡುತ್ತವೆ. ಅನೇಕ ವಿವಿಧ ರೀತಿಯ ಪ್ರತಿಕಾಯ ದೀರ್ಘ ಸರಪಣಿಗಳಿವೆ ಹಾಗೂ ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಅನೇಕ ವಿಧಗಳಿವೆ. ಪ್ರತಿಕಾಯಗಳನ್ನು ಅವು ಹೊಂದಿರುವ ದೀರ್ಘ ಸರಪಣಿಗಳ ಆಧಾರದಲ್ಲಿ ವಿವಿಧ ಐಸೊಟೈಪ್ಗಳಾಗಿ ವಿಂಗಡಿಸಲಾಗುತ್ತದೆ. ಸಸ್ತನಿಗಳಲ್ಲಿ ವಿವಿಧ ರೀತಿಯ ಐದು ಪ್ರತಿಕಾಯ ಐಸೊಟೈಪ್ಗಳು ಕಂಡುಬರುತ್ತವೆ. ಅವು ಸಸ್ತನಿಗಳಲ್ಲಿ ವಿವಿಧ ಪಾತ್ರವಹಿಸುತ್ತವೆ. ಅಲ್ಲದೇ ಸಸ್ತನಿಗಳು ಎದುರಿಸುವ ಪ್ರತಿಯೊಂದು ವಿವಿಧ ರೀತಿಯ ಹೊರಗಿನ ವಸ್ತುಗಳಿಗೆ ಪ್ರತಿರಕ್ಷಣಾ ಕ್ರಿಯೆಯನ್ನು ನಿರ್ದೇಶಿಸಲು ಸಹಾಯ ಮಾಡುತ್ತವೆ.[೨]
ಎಲ್ಲಾ ಪ್ರತಿಕಾಯಗಳ ಸಾಮಾನ್ಯ ರಚನೆಯು ಹೆಚ್ಚಾಗಿ ಒಂದೇ ರೀತಿ ಇದ್ದರೂ, ಪ್ರೋಟೀನ್ನ ತುದಿಯಲ್ಲಿರುವ ಒಂದು ಸಣ್ಣ ಭಾಗವು ಹೆಚ್ಚಾಗಿ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುತ್ತದೆ. ಇದು ವಿವಿಧ ರೀತಿಯ ತುದಿಯ ರಚನೆಗಳನ್ನು ಅಥವಾ ಪ್ರತಿಜನಕ(ಆಂಟಿಜೆನ್)ಗಳನ್ನು ಬಂಧಿಸುವ ಭಾಗಗಳನ್ನು ಹೊಂದಿರುವ ದಶಲಕ್ಷದಷ್ಟು ಪ್ರತಿಕಾಯಗಳು ಅಸ್ತಿತ್ವದಲ್ಲಿರುವಂತೆ ಮಾಡುತ್ತದೆ. ಈ ಭಾಗವನ್ನು ಹೆಚ್ಚಾಗಿ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ(ಹೈಪರ್ವೇರಿಯೇಬಲ್) ಭಾಗವೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಈ ಪ್ರತಿಯೊಂದು ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ-ಭಾಗವು ಪ್ರತಿಜನಕಗಳೆನ್ನುವ ವಿವಿಧ ರೀತಿಯ ಅಂಶಗಳೊಂದಿಗೆ ಬಂಧಿಸುತ್ತವೆ.[೩] ಪ್ರತಿಕಾಯಗಳಲ್ಲಿನ ಈ ಅತಿ ಹೆಚ್ಚಿನ ವಿಭಿನ್ನತೆಯು ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಗೆ ವಿವಿಧ ಪ್ರಕಾರದ ಪ್ರತಿಜನಕಗಳನ್ನು ಗುರುತಿಸಲು ಅನುವು ಮಾಡಿಕೊಡುತ್ತದೆ. ಪ್ರತಿಕಾಯದಿಂದ ಗುರುತಿಸಲ್ಪಡುವ ಪ್ರತಿಜನಕದ ಭಿನ್ನ ಭಾಗವನ್ನು ಎಪಿಟೋಪ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಈ ಎಪಿಟೋಪ್ಗಳು ಅವುಗಳ ಪ್ರತಿಕಾಯದೊಂದಿಗೆ ಪ್ರೇರಿತ ಹೊಂದಿಕೆ(ಇಂಡ್ಯೂಸ್ಡ್ ಫಿಟ್) ಎನ್ನುವ ಒಂದು ವಿಶೇಷ ಪರಸ್ಪರ-ಕ್ರಿಯೆಯ ಮೂಲಕ ಬಂಧಿಸುತ್ತವೆ. ಅದು ಜೀವಿಯನ್ನು ರಚಿಸುವ ಅನೇಕ ವಿವಿಧ ಅಣುಗಳ ಮಧ್ಯೆ ಪ್ರತಿಕಾಯಗಳು ಕೇವಲ ಅವುಗಳ ಭಿನ್ನ ಪ್ರತಿಜನಕವನ್ನು ಮಾತ್ರ ಗುರುತಿಸುವಂತೆ ಮತ್ತು ಅದರೊಂದಿಗೆ ಬಂಧಿಸುವಂತೆ ಮಾಡುತ್ತದೆ. ಪ್ರತಿಕಾಯದಿಂದ ಪ್ರತಿಜನಕದ ಗುರುತಿಸುವಿಕೆಯು ಅದನ್ನು ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯ ಇತರ ಭಾಗಗಳ ದಾಳಿಗೆ ಹೊಂದಿಸುತ್ತದೆ . ಪ್ರತಿಕಾಯಗಳು ಸೋಂಕನ್ನು ಉಂಟುಮಾಡುವ ರೋಗಕಾರಕದ ಭಾಗವೊಂದಕ್ಕೆ ಬಂಧಿಸುವ ಮೂಲಕ ಉದ್ದಿಷ್ಟ ಗುರಿಗಳನ್ನು ನೇರವಾಗಿ ತಟಸ್ಥಗೊಳಿಸಬಹುದು.[೪]
ಅತಿ ಹೆಚ್ಚಿನ ಮತ್ತು ವಿಭಿನ್ನ ಪ್ರಕಾರದ ಪ್ರತಿಕಾಯಗಳು ಅನೇಕ ಜೀನ್ ಅಂಶಗಳ ಯಾದೃಚ್ಛಿಕ ಸಂಯೋಗದಿಂದ ರಚನೆಯಾಗುತ್ತವೆ. ಈ ಅಂಶಗಳು ವಿವಿಧ ಪ್ರತಿಜನಕ ಬಂಧಿಸುವ ಭಾಗಗಳನ್ನು ಸಂಕೇತ-ಭಾಷೆಯಲ್ಲಿ (ಅಥವಾ ಪ್ಯಾರಾಟೋಪ್ಗಳು ) ಸೂಚಿಸುತ್ತವೆ, ನಂತರ ಈ ಪ್ರತಿಕಾಯ ಜೀನ್ನ ಈ ಭಾಗದಲ್ಲಿ ಯಾದೃಚ್ಛಿಕ ಹೊಸ ಪರಿವರ್ತನೆ ಉಂಟಾಗುತ್ತದೆ, ಇದು ಪ್ರತಿಕಾಯದ ವಿಭಿನ್ನತೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ.[೨][೫] ಪ್ರತಿಕಾಯ ಜೀನ್ಗಳು ಕ್ಲಾಸ್ ಸ್ವಿಚಿಂಗ್ ಎನ್ನುವ ಕ್ರಿಯೆಯ ಮೂಲಕ ಮತ್ತೆ-ಸಂಯೋಜಿಸಲ್ಪಡುತ್ತವೆ. ಈ ಕ್ರಿಯೆಯು ದೀರ್ಘ ಸರಪಣಿಯ ಆಧಾರವನ್ನು ಬೇರೆಯದಾಗಿ ಬದಲಾಯಿಸುತ್ತದೆ. ಇದರಿಂದಾಗಿ ಪ್ರತಿಜನಕವನ್ನು ಗುರುತಿಸುವ ಭಾಗವನ್ನು ಉಳಿಸಿಕೊಂಡ ಪ್ರತಿಕಾಯದ ಭಿನ್ನ ರೀತಿಯ ಐಸೊಟೈಪ್ ರಚನೆಯಾಗುತ್ತದೆ. ಇದು ಒಂದು ಪ್ರತಿಕಾಯವನ್ನು ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯ ಅನೇಕ ಭಾಗಗಳು ಬಳಸುವಂತೆ ಮಾಡುತ್ತದೆ. ಪ್ರತಿಕಾಯಗಳ ಉತ್ಪತ್ತಿಯು ರಸಧಾತುಗಳ(ಹ್ಯೂಮರಲ್) ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಒಂದು ಮುಖ್ಯ ಕ್ರಿಯೆಯಾಗಿದೆ.[೬]
ಪ್ರಕಾರಗಳು
[ಬದಲಾಯಿಸಿ]ಮೇಲ್ಮೈ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ (ಪ್ರತಿರಕ್ಷಣಾಗ್ಲಾಬ್ಯುಲಿನ್) (Ig) ಅದರ ಟ್ರಾನ್ಸ್ಮೆಂಬ್ರೇನ್ ಭಾಗದಿಂದ ಕಾರ್ಯನಿರ್ವಾಹಕ B ಜೀವಕೋಶಗಳ ಪೊರೆಯ ಮೇಲೆ ಅಂಟಿಕೊಂಡಿರುತ್ತದೆ. ಪ್ರತಿಕಾಯಗಳು Ig ಯಿಂದ ಸ್ರವಿಸಲ್ಪಟ್ಟ ರೂಪಗಳಾಗಿರುವುದರಿಂದ ಅವು ಟ್ರಾನ್ಸ್ಮೆಂಬ್ರೇನ್ ಭಾಗವನ್ನು ಹೊಂದಿರುವುದಿಲ್ಲ. ಆದ್ದರಿಂದ ಪ್ರತಿಕಾಯಗಳು ರಕ್ತಪ್ರವಾಹಕ್ಕೆ ಮತ್ತು ದೇಹದ ಪೊಳ್ಳು ಭಾಗಗಳಿಗೆ ಸ್ರವಿಸಲ್ಪಡುತ್ತವೆ. ಇದರಿಂದಾಗಿ ಮೇಲ್ಮೆ Ig ಮತ್ತು ಪ್ರತಿಕಾಯಗಳು ಟ್ರಾನ್ಸ್ಮೆಂಬ್ರೇನ್ ಭಾಗವನ್ನು ಹೊರತುಪಡಿಸಿ ಉಳಿದೆಲ್ಲಾ ರೀತಿಯಿಂದ ಒಂದೇ ಆಗಿರುತ್ತವೆ. ಆದ್ದರಿಂದ ಅವನ್ನು ಪ್ರತಿಕಾಯಗಳ ಎರಡು ಪ್ರಕಾರಗಳೆಂದು ಪರಿಗಣಿಸಲಾಗುತ್ತದೆ: ಕರಗುವ ಪ್ರಕಾರ ಅಥವಾ ಪೊರೆಯಿರುವ ಪ್ರಕಾರ (ಪರ್ಹ್ಯಾಮ್ 21-22).
ಪೊರೆಯಿರುವ ಪ್ರಕಾರದ ಪ್ರತಿಕಾಯವನ್ನು ಮೇಲ್ಮೆ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ (sIg) ಅಥವಾ ಪೊರೆ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ (mIg) ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇದು B ಜೀವಕೋಶ ಗ್ರಾಹಕ(ಸೆಲ್ ರಿಸೆಪ್ಟರ್) (BCR)ದ ಭಾಗವಾಗಿದೆ, ಇದು B ಜೀವಕೋಶವು ಒಂದು ನಿರ್ದಿಷ್ಟ ಪ್ರತಿಜನಕ ದೇಹದಲ್ಲಿ ಕಂಡುಬಂದಾಗ ಅದನ್ನು ಕಂಡುಹಿಡಿಯಲು ಅನುವು ಮಾಡಿಕೊಡುತ್ತದೆ. ಅಲ್ಲದೇ B ಜೀವಕೋಶದ ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆಯನ್ನು ಪ್ರೇರೇಪಿಸುತ್ತದೆ.[೭] BCR ಮೈಲ್ಮೆ IgD ಅಥವಾ IgM ಪ್ರತಿಕಾಯಗಳಿಂದ ಸಂಯೋಜಿಸಲ್ಪಟ್ಟಿರುತ್ತದೆ.ಅಲ್ಲದೇ (ವಂಶಪಾರಂಪರಿಕ ಅಂಶಗಳ ಸಂಕೇತ) ಸಂಕೇತ ಟ್ರಾನ್ಸ್ಡಕ್ಷನ್ನ ಸಾಮರ್ಥ್ಯ ಹೊಂದಿರುವ Ig-α ಮತ್ತು Ig-β (ಗುಣವಿಶೇಷಗಳನ್ನು)ಹೆಟಿರೊಡೈಮರ್ಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ.[೮] ಮಾನವನ ಒಂದು ಸಾಂಕೇತಿಕ B ಜೀವಕೋಶವು ಅದರ ಮೇಲ್ಮೆಗೆ ಅಂಟಿಕೊಂಡ ಸುಮಾರು 50,000ರಿಂದ 100,000 ಪ್ರತಿಕಾಯಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ.[೮] ಪ್ರತಿಜನಕವು ಬಂಧಿಸಲ್ಪಟ್ಟ ನಂತರ ಅವು BCRಗಳನ್ನು ಇತರ ಜೀವಕೋಶ-ಸಂಕೇತಿಸುವ ಗ್ರಾಹಕಗಳಿಂದ ಪ್ರತ್ಯೇಕಿಸುವ ಲಿಪಿಡ್ ಪೊರೆಗಳ ಮೇಲೆ ಸುಮಾರು 1 ಮೈಕ್ರೊಮೀಟರ್ ವ್ಯಾಸವನ್ನು ಹೊಂದಿರುವ ದೊಡ್ಡ ತೇಪೆಗಳಲ್ಲಿ ಗುಂಪುಗೂಡುತ್ತವೆ.[೮] ಈ ತೇಪೆಗಳು ಜೀವಕೋಶದ ಪ್ರತಿರಕ್ಷಣಾ ಪ್ರಕ್ರಿಯೆಯನ್ನು ಸುಧಾರಿಸುತ್ತವೆ.[೯] ಮಾನವರಲ್ಲಿ, ಜೀವಕೋಶದ ಮೇಲ್ಮೆಯು B ಜೀವಕೋಶ ಗ್ರಾಹಕಗಳ ಸುತ್ತ ಸಾವಿರಾರು ಆಂಗ್ಸ್ಟ್ರಾಮ್ಗಳಷ್ಟು[೮] ಉದ್ದಕ್ಕೆ ತೆರೆದಿರುತ್ತದೆ. ಅದು BCRಗಳನ್ನು ಹೆಚ್ಚಿನ ಪ್ರಭಾವಗಳಿಂದ ಮತ್ತಷ್ಟು ಪ್ರತ್ಯೇಕಿಸುತ್ತದೆ.
ಐಸೊಟೈಪ್ಗಳು
[ಬದಲಾಯಿಸಿ]| ಹೆಸರು | ಪ್ರಕಾರಗಳು | ವಿವರಣೆ | ಪ್ರತಿಕಾಯ ಸಂಕೀರ್ಣಗಳು | ||||||||||||||||
| IgA | 2 | ಕರುಳು, ಶ್ವಾಸೇಂದ್ರಿಯ ಪ್ರದೇಶ ಹಾಗೂ ಮೂತ್ರಾಂಗ ಮತ್ತು ಜನನೇಂದ್ರಿಯಗಳಿಗೆ ಸಂಬಂಧಿಸಿದ ಪ್ರದೇಶಗಳಂತಹ ಮ್ಯುಕೋಸಲ್ ಜಾಗಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ ಹಾಗೂ ರೋಗಜನಕಗಳ ಆಕ್ರಮಣವನ್ನು ತಡೆಗಟ್ಟುತ್ತದೆ.[೧೦] ಲಾಲಾರಸ, ಕಣ್ಣೀರು ಮತ್ತು ಎದೆಹಾಲಿನಲ್ಲೂ ಕಂಡುಬರುತ್ತದೆ. | 
|
- | IgD | 1 | ಪ್ರತಿಜನಕಗಳಿಗೆ ಒಡ್ಡಿಕೊಳ್ಳದ Bಜೀವಕೇಶಗಳಲ್ಲಿ ಪ್ರತಿಜನಕ ಗ್ರಾಹಕವಾಗಿ ಕಾರ್ಯನಿರ್ವಹಿಸುತ್ತದೆ.[೧೧] ಇದು ಆಂಟಿಮೈಕ್ರೊಬಿಯಲ್ ಅಂಶಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡಲು ಬಾಸೊಫಿಲ್ ಮತ್ತು ಮಾಸ್ಟ್ ಜೀವಕೋಶಗಳನ್ನು ಸಕ್ರಿಯಗೊಳಿಸುತ್ತದೆಂದು ಹೇಳಲಾಗುತ್ತದೆ.[೧೨] | - | IgE | 1 | ಅಲರ್ಜಿಕಾರಕಗಳನ್ನು ಬಂಧಿಸುತ್ತದೆ, ಮಾಸ್ಟ್ ಜೀವಕೋಶಗಳು ಮತ್ತು ಬಾಸೊಫಿಲ್ಗಳಿಂದ ಬಿಡುಗಡೆಯಾಗುವ ಹಿಸ್ಟಮೈನ್ಗಳನ್ನು ಉತ್ತೇಜಿಸುತ್ತದೆ ಹಾಗೂ ಇದು ಅಲರ್ಜಿಯಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತದೆ. ಪರೋಪಜೀವಿಯಾದ ಜಂತುಗಳ ವಿರುದ್ಧವೂ ರಕ್ಷಣೆಯನ್ನು ಒದಗಿಸುತ್ತದೆ.[೬] | - | IgG | 4 | ಅದರ ನಾಲ್ಕು ರೂಪಗಳಲ್ಲಿ,ಆಕ್ರಮಣಕಾರಿ ರೋಗಕಾರಕಗಳ ವಿರುದ್ಧ ಅತಿ ಹೆಚ್ಚಿನ ಪ್ರತಿಕಾಯ-ಆಧಾರಿತ ಪ್ರತಿರಕ್ಷೆಯನ್ನು ಒದಗಿಸುತ್ತದೆ.[೬] ಭ್ರೂಣಕ್ಕೆ ನಿಷ್ಕ್ರಿಯ ಪ್ರತಿರಕ್ಷೆಯನ್ನು ನೀಡಲು ಪ್ಲಾಸೆಂಟಾವನ್ನು ಭೇದಿಸುವ ಸಾಮರ್ಥ್ಯವನ್ನು ಹೊಂದಿರುವ ಏಕೈಕ ಪ್ರತಿಕಾಯವಿದು. | - | IgM | 1 | ಇದು B ಜೀವಕೋಶಗಳ ಮೇಲ್ಮೆಯಲ್ಲಿ ಬಿಡುಗಡೆಗೊಳ್ಳುತ್ತದೆ ಮತ್ತು ಸ್ರಾವದ ರೂಪದಲ್ಲಿ ಅತಿ ಹೆಚ್ಚಿನ ವೇಗವನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಇದು ಸಾಕಷ್ಟು IgG ಇರುವುದಕ್ಕಿಂತ ಮೊದಲು B ಜೀವಕೋಶ ಮಧ್ಯವರ್ತಿಯ (ರಸಧಾತುಗಳ) ಪ್ರತಿರಕ್ಷೆಯ ಆರಂಭಿಕ ಹಂತಗಳಲ್ಲಿ ರೋಗಕಾರಕಗಳನ್ನು ತೆಗೆದುಹಾಕುತ್ತದೆ.[೬][೧೧] |
ಪ್ರತಿಕಾಯಗಳು, ಐಸೊಟೈಪ್ಗಳು ಅಥವಾ ಶ್ರೇಣೀಕೃತ ಎನ್ನುವ ವಿವಿಧ ಪ್ರಕಾರಗಳಾಗಿ ಕಂಡುಬರುತ್ತವೆ. ಜರಾಯುಯುಕ್ತ ಸಸ್ತನಿಗಳಲ್ಲಿ ಐದು ಪ್ರತಿಕಾಯ ಐಸೊಟೈಪ್ಗಳಿರುತ್ತವೆ, ಅವುಗಳೆಂದರೆ - IgA, IgD, IgE, IgG ಮತ್ತು IgM. ಅವನ್ನು "Ig" ಎಂಬ ಪೂರ್ವಪ್ರತ್ಯಯದಿಂದ ಸೂಚಿಸಲಾಗುತ್ತದೆ, Ig ಎಂದರೆ ಪ್ರತಿಕಾಯದ ಮತ್ತೊಂದು ಹೆಸರು; ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್. ಕೋಷ್ಟಕದಲ್ಲಿ ವಿವರಿಸಿದಂತೆ ಅವುಗಳ ಜೈವಿಕ ಗುಣಲಕ್ಷಣಗಳು, ಕ್ರಿಯೆ ನಡೆಸುವ ಜಾಗಗಳು ಭಿನ್ನವಾಗಿರುತ್ತವೆ.ಅಲ್ಲದೇ ಅವು ವಿವಿಧ ಪ್ರತಿಜನಕಗಳೊಂದಿಗೆ ಕ್ರಿಯೆ ನಡೆಸುವ ಸಾಮರ್ಥ್ಯವನ್ನೂ ಹೊಂದಿರುತ್ತವೆ.[೧೩]
B ಜೀವಕೋಶದ ಪ್ರತಿಕಾಯ ಐಸೊಟೈಪ್, ಜೀವಕೋಶದ ಬೆಳವಣಿಗೆ ಮತ್ತು ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ ಬದಲಾಗುತ್ತದೆ. ಪ್ರತಿಜನಕದ ಪ್ರಭಾವಕ್ಕೆ ಒಳಗಾಗದ, ಬೆಳೆಯದ B ಜೀವಕೋಶಗಳನ್ನು ನೈವ್ B ಜೀವಕೋಶಗಳೆನ್ನುತ್ತಾರೆ. ಅವು ಜೀವಕೋಶದ ಮೇಲ್ಮೆಯಲ್ಲಿ ಕೇವಲ IgM ಐಸೊಟೈಪ್ಅನ್ನು ಮಾತ್ರ ವ್ಯಕ್ತಪಡಿಸುತ್ತವೆ. B ಜೀವಕೋಶಗಳು ಸಂಪೂರ್ಣವಾಗಿ ಬೆಳೆದಾಗ IgM ಮತ್ತು IgD ಎರಡನ್ನೂ ಅಭಿವ್ಯಕ್ತಪಡಿಸುತ್ತವೆ. ಈ ಎರಡೂ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಐಸೊಟೈಪ್ಗಳ ಸಹ-ಅಭಿವ್ಯಕ್ತಿಯು B ಜೀವಕೋಶದ 'ಸಂಪೂರ್ಣ-ಬೆಳವಣಿಗೆ'ಯನ್ನು ಹಾಗೂ ಪ್ರತಿಜನಕಕ್ಕೆ ಪ್ರತಿಕ್ರಿಯಿಸಲು ತಯಾರಾಗಿದೆ ಎಂಬುದನ್ನು ಸೂಚಿಸುತ್ತದೆ.[೧೪] B ಜೀವಕೋಶದ ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆಯ ನಂತರ ಜೀವಕೋಶಕ್ಕೆ ಅಂಟಿರುವ ಪ್ರತಿಕಾಯ ಅಣುವು ಪ್ರತಿಜನಕದೊಂದಿಗೆ ಕೂಡಿಕೊಳ್ಳುತ್ತದೆ. ಇದು ಜೀವಕೋಶ ವಿಭಜಿಸಿ, ಪ್ಲಾಸ್ಮಾ ಜೀವಕೋಶ ಎನ್ನುವ ಪ್ರತಿಕಾಯವನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವ(ಅಂಗಾಂಶ) ಜೀವಕೋಶವಾಗಿ ಪ್ರತ್ಯೇಕಗೊಳ್ಳಲು ಕಾರಣವಾಗುತ್ತದೆ. ಈ ಸಕ್ರಿಯ ರೂಪದಲ್ಲಿ B ಜೀವಕೋಶವು ಪ್ರತಿಕಾಯವನ್ನು ಪೊರೆಯ ರೂಪದ ಬದಲಿಗೆ ಸ್ರವಿಸುವ ರೂಪದಲ್ಲಿ ಉತ್ಪತ್ತಿ ಮಾಡಲು ಆರಂಭಿಸುತ್ತದೆ. B ಜೀವಕೋಶಗಳ ಕೆಲವು ಮರಿ ಜೀವಕೋಶಗಳು(ಜೀವಕೋಶವೊಂದರ ವಿದಳನದಿಂದ ದೊರೆತ ಇನ್ನೊಂದು ಜೀವಕೋಶ) ಐಸೊಟೈಪ್ ಸ್ವಿಚಿಂಗ್ ಎಂಬ ಕ್ರಿಯೆಗೊಳಗಾಗುತ್ತವೆ, ಇದು ಪ್ರತಿಕಾಯಗಳು IgM ಅಥವಾ IgD ಯಿಂದ ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯಲ್ಲಿ ಒಂದು ನಿರೂಪಿತ ಪಾತ್ರವನ್ನು ಹೊಂದಿರುವ IgE, IgA ಅಥವಾ IgG ಎಂಬ ಇತರ ಪ್ರತಿಕಾಯ ಐಸೊಟೈಪ್ಗಳಾಗಿ ಬದಲಾಗುವಂತೆ ಮಾಡುವ ಒಂದು ಕ್ರಿಯೆಯಾಗಿದೆ.
ರಚನೆ
[ಬದಲಾಯಿಸಿ]ಪ್ರತಿಕಾಯಗಳು ದೀರ್ಘ (~150 kDa) ಗೋಳಕಣಗಳಿಂದ ಘಟಿತವಾದ ಪ್ಲಾಸ್ಮಾ ಪ್ರೋಟೀನ್ಗಳಾಗಿವೆ. ಅವುಗಳಲ್ಲಿ ಶರ್ಕರ ಸರಪಣಿಗಳು ಅವುಗಳ ಕೆಲವು ಅಮೈನೊ ಆಮ್ಲ ಉಳಿಕೆಗಳೊಂದಿಗೆ ಕೂಡಿಕೊಂಡಿರುತ್ತವೆ.[೧೫] ಬೇರೆ ರೀತಿಯಲ್ಲಿ ಹೇಳುವುದಾದರೆ, ಪ್ರತಿಕಾಯಗಳು ಗ್ಲೈಕೊಪ್ರೋಟೀನ್ಗಳಾಗಿವೆ . ಪ್ರತಿಯೊಂದು ಪ್ರತಿಕಾಯದ ಮೂಲ ಕ್ರಿಯಾತ್ಮಕ ಘಟಕವೆಂದರೆ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ (Ig) ಮಾನೊಮರ್ (ಕೇವಲ ಒಂದು Ig ಘಟಕವನ್ನು ಹೊಂದಿರುತ್ತದೆ); ಸ್ರವಿಸಲ್ಪಟ್ಟ ಪ್ರತಿಕಾಯಗಳು IgA ಅಂತೆ ಎರಡು Ig ಘಟಕಗಳನ್ನು ಹೊಂದಿರುವ ಡೈಮರಿಕ್(ಪ್ರೊಟೀನ್ ಯುಕ್ತ) ಆಗಿರಬಹುದು, ಟೆಲಿಯಾಸ್ಟೀ ಮೀನು IgM ಅಂತೆ ನಾಲ್ಕು Ig ಘಟಕಗಳನ್ನು ಹೊಂದಿರುವ ಟೆಟ್ರಾಮರಿಕ್ ಆಗಿರಬಹುದು ಅಥವಾ ಸಸ್ತನಿಯ IgM ಅಂತೆ ಐದು Ig ಘಟಕಗಳನ್ನು ಹೊಂದಿರುವ ಪೆಂಟಾಮರಿಕ್ ಆಗಿರಬಹುದು.[೧೬]

ಪ್ರತಿಕಾಯದ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗಗಳೆಂದರೆ V ಭಾಗಗಳು ಹಾಗೂ ಸ್ಥಿರವಾಗಿರುವ ಭಾಗವೆಂದರೆ C ಭಾಗ.
ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಡೊಮೇನ್ಗಳು(ರೋಗ ನಿರೋಧಕ ಶಕ್ತಿಯ ವಲಯಗಳು)
[ಬದಲಾಯಿಸಿ]Ig ಮಾನೊಮರ್ "Y"-ಆಕಾರದ ಅಣುವಾಗಿದ್ದು, ಅದು ನಾಲ್ಕು ಪಾಲಿಪೆಪ್ಟೈಡ್ ಸರಪಣಿಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ; ಎರಡು ಒಂದೇ ರೀತಿಯ ದೀರ್ಘ ಸರಪಣಿಗಳು ಮತ್ತು ಸರಳ ಸರಪಣಿಗಳು ಡೈಸಲ್ಫೈಡ್ ಬಂಧಗಳಿಂದ ಕೂಡಿಕೊಂಡಿರುತ್ತವೆ.[೧೩] ಪ್ರತಿಯೊಂದು ಸರಪಣಿಯು ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಡೊಮೇನ್ಗಳೆನ್ನುವ ರಚನಾತ್ಮಕ ಡೊಮೇನ್ಗಳಿಂದ ರಚಿತವಾಗಿರುತ್ತವೆ. ಈ ಡೊಮೇನ್ಗಳು ಸುಮಾರು 70-110 ಅಮೈನೊ ಆಮ್ಲಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.ಅಲ್ಲದೇ ಅವುಗಳ ಗಾತ್ರ ಮತ್ತು ಕ್ರಿಯೆಯ ಆಧಾರದಲ್ಲಿ ಅವನ್ನು ವಿವಿಧ ವರ್ಗಗಳಾಗಿ (ಉದಾಹರಣೆಗಾಗಿ, ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಅಥವಾ IgV ಮತ್ತು ಸ್ಥಿರ ಅಥವಾ IgC ಆಧಾರದ ಮೇಲೆ) ವಿಂಗಡಿಸಲಾಗುತ್ತದೆ.[೧೭] ಅವು ಒಂದು ವಿಶಿಷ್ಟ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಪದರವನ್ನು ಹೊಂದಿರುತ್ತವೆ, ಅದರಲ್ಲಿ ಎರಡು ಬೀಟಾ ಶೀಟ್ಗಳು “ಸ್ಯಾಂಡ್ವಿಚ್” ಆಕಾರವನ್ನು ರಚಿಸುತ್ತವೆ. ಅವು ರಕ್ಷಿತ(ಪ್ರೊಟೀನ್ ಗಳಲ್ಲಿ ಕಂಡು ಬರುವ ಅಮಿನೊ ಆಮ್ಲ) ಸಿಸ್ಟೈನ್ಗಳ ಮತ್ತು ಇತರ ವಿದ್ಯುದಾವೇಶದ ಅಮೈನೊ ಆಮ್ಲಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳ ಮೂಲಕ ಒಟ್ಟಿಗೆ ಕೂಡಿಕೊಂಡಿರುತ್ತವೆ.
ದೀರ್ಘ ಸರಪಣಿ
[ಬದಲಾಯಿಸಿ]ಐದು ಪ್ರಕಾರದ ಸಸ್ತನಿಗಳ Ig ದೀರ್ಘ ಸರಪಣಿಗಳಿವೆ, ಅವನ್ನು ಗ್ರೀಕ್ ಅಕ್ಷರಗಳಿಂದ ಸೂಚಿಸಲಾಗುತ್ತದೆ: α, δ, ε, γ ಮತ್ತು μ.[೩] ದೀರ್ಘ ಸರಪಣಿಯ ಪ್ರಕಾರವು ಪ್ರತಿಕಾಯದ ವರ್ಗ ವನ್ನು ನಿರೂಪಿಸುತ್ತದೆ; ಆ ಸರಪಣಿಗಳು ಅನುಕ್ರಮವಾಗಿ IgA, IgD, IgE, IgG ಮತ್ತು IgM ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ.[೪] ವಿಶಿಷ್ಟ ದೀರ್ಘ ಸರಪಣಿಗಳು ಗಾತ್ರ ಮತ್ತು ರಚನೆಯಲ್ಲಿ ಭಿನ್ನವಾಗಿರುತ್ತವೆ; α ಮತ್ತು γ ಸರಿಸುಮಾರು 450 ಅಮೈನೊ ಆಮ್ಲಗಳನ್ನು ಹಾಗೂ μ ಮತ್ತು ε ಸುಮಾರು 550 ಅಮೈನೊ ಆಮ್ಲಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.[೩]

ಪ್ರತಿಯೊಂದು ದೀರ್ಘ ಸರಪಣಿಯು ಎರಡು ಭಾಗಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ - ಸ್ಥಿರ ಭಾಗ ಮತ್ತು ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗ . ಸ್ಥಿರ ಭಾಗವು ಒಂದೇ ರೀತಿಯ ಐಸೊಟೈಪ್ಅನ್ನು ಹೊಂದಿರುವ ಎಲ್ಲಾ ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಒಂದೇ ರೀತಿ ಇರುತ್ತದೆ. ಆದರೆ ಇದು ಬೇರೆಬೇರೆ ಐಸೊಟೈಪ್ಗಳನ್ನು ಹೊಂದಿರುವ ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಬೇರೆಬೇರೆಯಾಗಿರುತ್ತದೆ. ದೀರ್ಘ ಸರಪಣಿಗಳಾದ γ, α ಮತ್ತು δ ಮೂರು ಸಾಲಿನ Ig ಡೊಮೇನ್ಗಳನ್ನು ಒಳಗೊಂಡ ಒಂದು ಸ್ಥಿರ ಭಾಗವನ್ನು ಹಾಗೂ ಹೆಚ್ಚುವರಿ ನಮ್ಯತೆಗಾಗಿ ಒಂದು ಕೀಲು(ಹಿಂಜ್) ಭಾಗವನ್ನು ಹೊಂದಿರುತ್ತವೆ;[೧೩] ದೀರ್ಘ ಸರಪಣಿಗಳಾದ μ ಮತ್ತು ε ನಾಲ್ಕು ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಡೊಮೇನ್ಗಳನ್ನು ಒಳಗೊಂಡ ಒಂದು ಸ್ಥಿರ ಭಾಗವನ್ನು ಹೊಂದಿರುತ್ತವೆ.[೩] ದೀರ್ಘ ಸರಪಣಿಯ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗವು ವಿವಿಧ B ಜೀವಕೋಶಗಳಿಂದ ಉತ್ಪತ್ತಿಯಾದ ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಭಿನ್ನವಾಗಿರುತ್ತದೆ. ಆದರೆ ಇದು ಒಂದು B ಜೀವಕೋಶ ಅಥವಾ B ಜೀವಕೋಶ ಕ್ಲೋನ್ನಿಂದ ಉತ್ಪತ್ತಿಯಾದ ಎಲ್ಲಾ ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಒಂದೇ ರೀತಿ ಇರುತ್ತದೆ. ಪ್ರತಿಯೊಂದು ದೀರ್ಘ ಸರಪಣಿಯ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗವು ಸರಿಸುಮಾರು 110 ಅಮೈನೊ ಆಮ್ಲಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ ಹಾಗೂ ಒಂದು Ig ಡೊಮೇನ್ನಿಂದ ರಚಿತವಾಗಿರುತ್ತದೆ.
ಸರಳ ಸರಪಣಿ
[ಬದಲಾಯಿಸಿ]ಸಸ್ತನಿಗಳಲ್ಲಿ ಎರಡು ರೀತಿಯ(ರೋಗ ನಿರೋಧಕಗಳ ಅಂಶಗಳುಳ್ಳ ಪ್ರೊಟೀನ್ ಸಹಿತ ಜೀವಕೋಶ) ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಸರಳ ಸರಪಣಿಗಳಿವೆ, ಅವನ್ನು ಲ್ಯಾಂಬ್ಡ (λ) ಮತ್ತು ಕಪ್ಪ (κ) ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.[೩] ಸರಳ ಸರಪಣಿಯೊಂದು ಎರಡು ಅನುಕ್ರಮ ಡೊಮೇನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ: ಒಂದು ಸ್ಥಿರ ಡೊಮೇನ್, ಮತ್ತೊಂದು ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್. ಸರಳ ಸರಪಣಿಯ ಸರಿಸುಮಾರು ಉದ್ದವೆಂದರೆ 211ರಿಂದ 217 ಅಮೈನೊ ಆಮ್ಲಗಳು.[೩] ಪ್ರತಿಯೊಂದು ಪ್ರತಿಕಾಯವು ಒಂದೇ ರೀತಿಯಿರುವ ಎರಡು ಸರಳ ಸರಪಣಿಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ; ಸಸ್ತನಿಗಳಲ್ಲಿ ಒಂದು ಪ್ರತಿಕಾಯದಲ್ಲಿ ಕೇವಲ ಒಂದು ಪ್ರಕಾರದ ಸರಳ ಸರಪಣಿ, κ ಅಥವಾ λ, ಮಾತ್ರ ಇರುತ್ತದೆ. ಐಯೋಟ (ι) ಸರಪಣಿಯಂತಹ ಇತರ ಪ್ರಕಾರದ ಸರಳ ಸರಪಣಿಗಳು ಕಾಂಡ್ರಿಕ್ತೈಸ್ ಮತ್ತು ಟೆಲಿಯೊಸ್ಟೈ ಮೊದಲಾದ ಕೆಳವರ್ಗದ ಕಶೇರುಕಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ.
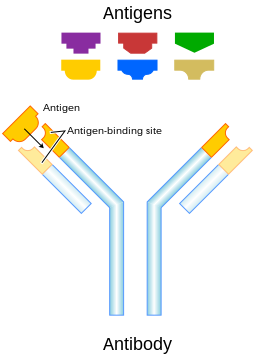
CDR, Fv, Fab ಮತ್ತು Fc ಭಾಗಗಳು(ಸಂಕೇತದ ಚಿನ್ಹೆ)
[ಬದಲಾಯಿಸಿ]ಪ್ರತಿಕಾಯದ ಕೆಲವು ಭಾಗಗಳು ಭಿನ್ನ ಕ್ರಿಯೆಗಳನ್ನು ನಿರ್ವಹಿಸುತ್ತವೆ. ಉದಾಹರಣೆಗಾಗಿ, Y ಯ ಕವಲುಗಳು ಪ್ರತಿಜನಕವನ್ನು ಬಂಧಿಸುವ ಭಾಗವನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಆ ಮೂಲಕ ಅದು ನಿರ್ದಿಷ್ಟ ಹೊರಗಿನ ವಸ್ತುಗಳನ್ನು ಗುರುತಿಸುತ್ತದೆ. ಪ್ರತಿಕಾಯದ ಈ ಭಾಗವನ್ನು Fab (ಫ್ರ್ಯಾಗ್ಮೆಂಟ್, ಆಂಟಿಜೆನ್ ಬೈಂಡಿಂಗ್) ಭಾಗ ವೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇದು ಪ್ರತಿಕಾಯದ ಪ್ರತಿಯೊಂದು ದೀರ್ಘ ಮತ್ತು ಸರಳ ಸರಪಣಿಯಿಂದ ಒಂದು ಸ್ಥಿರ ಮತ್ತು ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ಅನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ.[೧೮] ಪ್ಯಾರಾಟೋಪ್, ದೀರ್ಘ ಮತ್ತು ಸರಳ ಸರಪಣಿಗಳ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ಗಳಿಂದ ಪ್ರತಿಕಾಯ ಮಾನೊಮರ್ನ ಅಮೈನೊ ತುದಿಯಲ್ಲಿ ರಚನೆಯಾಗುತ್ತದೆ. ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ಅನ್ನು FV ಭಾಗವೆಂದೂ ಸೂಚಿಸಲಾಗುತ್ತದೆ.ಅಲ್ಲದೇ ಇದು ಪ್ರತಿಜನಕಗಳೊಂದಿಗೆ ಬಂಧಿಸುವಾಗ ಅತಿ ಮುಖ್ಯ ಭಾಗವಾಗಿರುತ್ತದೆ. ಪ್ರತಿಯೊಂದು ಸರಳ (VL) ಮತ್ತು ದೀರ್ಘ (VH) ಸರಪಣಿಗಳ ಮೇಲೆ ಮೂರಿರುವ, ವಿಶೇಷವಾಗಿ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಕುಣಿಕೆಗಳು ಪ್ರತಿಜನಕದ ಬಂಧಕ್ಕೆ ಜವಾಬ್ದಾರವಾಗಿರುತ್ತವೆ. ಈ ಕುಣಿಕೆಗಳನ್ನು ಕಾಂಪ್ಲಿಮೆಂಟಾರಿಟಿ ಡಿಟರ್ಮೈನಿಂಗ್ ರೀಜನ್(ಒಟ್ಟು ಸಂಯೋಜಿಸಿದ ಕಾರಣಗಳ ನಿರ್ಧಾರ) (CDR)ಗಳೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಪ್ರತಿರಕ್ಷಣಾ ಜಾಲ ಸಿದ್ಧಾಂತದ ಆಧಾರಚೌಕಟ್ಟಿನಲ್ಲಿ, CDR ಗಳನ್ನು ಐಡಿಯೊಟೈಪ್ಗಳೆಂದೂ ಕರೆಯುತ್ತಾರೆ. ಪ್ರತಿರಕ್ಷಣಾ ಜಾಲ ಸಿದ್ಧಾಂತದ ಪ್ರಕಾರ, ಹೊಂದಿಕೊಳ್ಳಬಲ್ಲ ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯನ್ನು ಐಡಿಯೊಟೈಪ್ಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳ ಮೂಲಕ ನಿಯಂತ್ರಿಸಲಾಗುತ್ತದೆ.
Y ದ ಆಧಾರವು ಪ್ರತಿರಕ್ಷಣಾ ಜೀವಕೋಶದ ಸಕ್ರಿಯತೆಯನ್ನು ಸರಿಹೊಂದಿಸುವಲ್ಲಿ ಪ್ರಮುಖ ಪಾತ್ರವಹಿಸುತ್ತದೆ. ಈ ಭಾಗವನ್ನು Fc (ಫ್ರ್ಯಾಗ್ಮೆಂಟ್, ಕ್ರಿಸ್ಟಲೈಜೇಸಬಲ್) ಭಾಗ ವೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇದು ಪ್ರತಿಕಾಯದ ವರ್ಗದ ಆಧಾರದಲ್ಲಿ ಎರಡು ಅಥವಾ ಮೂರು ಸ್ಥಿರ ಡೊಮೇನ್ಗಳನ್ನು ನೀಡುವ ಎರಡು ದೀರ್ಘ ಸರಪಣಿಗಳನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ.[೩] ನಿರ್ದಿಷ್ಟ ಪ್ರೋಟೀನ್ಗಳೊಂದಿಗೆ ಬಂಧಿಸುವ ಮೂಲಕ Fc ಭಾಗವು, ಪ್ರತಿಯೊಂದು ಪ್ರತಿಕಾಯವು ನಿರ್ದಿಷ್ಟ ಪ್ರತಿಜನಕಕ್ಕೆ ಸೂಕ್ತವಾದ ಪ್ರತಿರಕ್ಷಣಾ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ಒದಗಿಸುತ್ತಿದೆಯೇ ಎಂಬುದನ್ನು ಖಚಿತಪಡಿಸುತ್ತದೆ.[೧೯] Fc ಭಾಗವು Fc ಗ್ರಾಹಕಗಳಂತಹ ವಿವಿಧ ಜೀವಕೋಶ ಗ್ರಾಹಕಗಳೊಂದಿಗೆ ಮತ್ತು ಪೂರಕ ಪ್ರೋಟೀನ್ಗಳಂತಹ ಇತರ ಪ್ರತಿರಕ್ಷಣಾ ಅಣುಗಳೊಂದಿಗೂ ಬಂಧಿಸುತ್ತದೆ. ಈ ಮೂಲಕ ಇದು ಆಪ್ಸೊನೈಜೇಶನ್, ಜೀವಕೋಶದ ಲೈಸಿಸ್, ಮತ್ತು ಡಿಗ್ರ್ಯಾನುಲೇಶನ್ ಮಾಸ್ಟ್ ಜೀವಕೋಶಗಳು, ಬಾಸೊಫಿಲ್ಗಳು ಹಾಗೂ ಇಯೊಸಿನೊಫಿಲ್ಗಳು ಮೊದಲಾದ ಅನೇಕ ಮಾನಸಿಕ ಪರಿಣಾಮಗಳ ಮಧ್ಯಸ್ಥಿಕೆ ವಹಿಸುತ್ತದೆ.[೧೩]{8/){3}
ಕ್ರಿಯೆ
[ಬದಲಾಯಿಸಿ]ಸಕ್ರಿಯ B ಜೀವಕೋಶಗಳು ಕರಗುವ ಪ್ರತಿಕಾಯವನ್ನು ಸ್ರವಿಸುವ ಪ್ಲಾಸ್ಮಾ ಜೀವಕೋಶಗಳೆನ್ನುವ ಪ್ರತಿಕಾಯವನ್ನು-ಉತ್ಪಾದಿಸುವ ಜೀವಕೋಶಗಳಾಗಿ ಅಥವಾ ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯು ಪ್ರತಿಜನಕವನ್ನು ಜ್ಞಾಪಿಸಿಕೊಂಡು ಮುಂದಿನ ಒಡ್ಡುವಿಕೆಯ ಸಂದರ್ಭದಲ್ಲಿ ವೇಗವಾಗಿ ಪ್ರತಿಕ್ರಿಯಿಸುವಂತೆ ಮಾಡುವುದಕ್ಕಾಗಿ ದೇಹದಲ್ಲಿ ಅನೇಕ ವರ್ಷಗಳ ಕಾಲ ಉಳಿಯುವ ಜ್ಞಾಪಕ ಜೀವಕೋಶಗಳಾಗಿ ವ್ಯತ್ಯಾಸ ತೋರಿಸುತ್ತವೆ.[೨೦]
ಬದುಕಿನ ಸ್ವಾಭಾವಿಕ ಪ್ರಸವಪೂರ್ವ ಹಂತದಲ್ಲಿ ಮತ್ತು ಆಗತಾನೆ ಜನಿಸಿದ ಅವಧಿಯಲ್ಲಿ, ಪ್ರತಿಕಾಯಗಳು ತಾಯಿಯಿಂದ ನಿಷ್ಟ್ರಿಯ ಪ್ರತಿರಕ್ಷಣೆಯ ಮೂಲಕ ಪರಿಹಾರ ಒದಗಿಸಲ್ಪಡುತ್ತವೆ. ಆರಂಭಿಕ ಅಂತರ್ವರ್ಧಕ ಪ್ರತಿಕಾಯದ ಉತ್ಪತ್ತಿಯು ವಿವಿಧ ಪ್ರಕಾರದ ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಭಿನ್ನವಾಗಿರುತ್ತದೆ.ಅಲ್ಲದೇ ಇದು ಸಾಮಾನ್ಯವಾಗಿ ಜೀವನದ ಮೊದಲ ಕೆಲವು ವರ್ಷಗಳ ಕಾಲ ಕಂಡುಬರುತ್ತದೆ. ಪ್ರತಿಕಾಯಗಳು ರಕ್ತಪ್ರವಾಹದಲ್ಲಿ ಸ್ವತಂತ್ರವಾಗಿ ಕಂಡುಬರುವುದರಿಂದ, ಅವನ್ನು ರಸಧಾತುಗಳ ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯ ಭಾಗವೆಂದು ಹೇಳಲಾಗುತ್ತದೆ. ಹರಡುವ ಪ್ರತಿಕಾಯಗಳು ಕ್ಲೋನಲ್(ಅಬೀಜ ಸಂತಾನದ) B ಜೀವಕೋಶಗಳಿಂದ ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ, ಅವು ನಿರ್ದಿಷ್ಟವಾಗಿ ಕೇವಲ ಒಂದು ಪ್ರತಿಜನಕಕ್ಕೆ (ಒಂದು ಉದಾಹರಣೆಯೆಂದರೆ ವೈರಸ್ ಕ್ಯಾಪ್ಸಿಡ್ ಪ್ರೋಟೀನ್ ಭಾಗ) ಮಾತ್ರ ಪ್ರತಿಕ್ರಿಯಿಸುತ್ತವೆ. ಪ್ರತಿಕಾಯಗಳು ಪ್ರತಿರಕ್ಷೆಗೆ ಮೂರು ವಿಧಾನಗಳಲ್ಲಿ ಕೊಡುಗೆಯನ್ನು ನೀಡುತ್ತವ: ಅವು ರೋಗಕಾರಕಗಳು ಜೀವಕೋಶಗಳೊಳಗೆ ಪ್ರವೇಶಿಸಿ ಅವುಗಳೊಂದಿಗೆ ಕೂಡಿಕೊಂಡು ಹಾನಿಯನ್ನುಂಟುಮಾಡದ ಹಾಗೆ ತಡೆಯುತ್ತವೆ; ಅವು ಮ್ಯಾಕ್ರೊಫೇಜ್ಗಳಿಂದ ರೋಗಕಾರಕಗಳನ್ನು ತೆಗೆದುಹಾಕುವಿಕೆ ಮತ್ತು ಇತರ ಜೀವಕೋಶಗಳಿಂದ ರೋಗಕಾರಕವನ್ನು ಮುಚ್ಚುವ ಮೂಲಕ ತೆಗೆದುಹಾಕುವುದನ್ನು ಉತ್ತೇಜಿಸುತ್ತವೆ; ಅವು ಪೂರಕ ಪ್ರತಿಕ್ರಿಯಾ ಸರಣಿಯಂತಹ ಇತರ ಪ್ರತಿರಕ್ಷಣಾ ಪ್ರಕ್ರಿಯೆಯನ್ನು ಉತ್ತೇಜಿಸುವ ಮೂಲಕ ರೋಗಕಾರಕಗಳನ್ನು ನಾಶಮಾಡುತ್ತವೆ.[೨೧]

ಪೂರಕದ (ಕಾಂಪ್ಲಿಮೆಂಟ್ನ) ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆ
[ಬದಲಾಯಿಸಿ]ಉದಾಹರಣೆಗಾಗಿ, ಬ್ಯಾಕ್ಟೀರಿಯಾಗಳ ಮೇಲಿನ ಮೇಲ್ಮೆ ಪ್ರತಿಜನಕಗಳ ಮೇಲೆ ಬಂಧಿಸಿರುವ ಪ್ರತಿಕಾಯಗಳು ಪೂರಕ ಕಾಸ್ಕೇಡ್ನ ಮೊದಲ ಅಂಶವನ್ನು ಅವುಗಳ Fc ಭಾಗದೊಂದಿಗೆ ಆಕರ್ಷಿಸುತ್ತವೆ ಮತ್ತು "ಕ್ಲಾಸಿಕಲ್" ಪೂರಕ ವ್ಯವಸ್ಥೆಯ ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆಯನ್ನು ಆರಂಭಿಸುತ್ತವೆ.[೨೧] ಇದು ಬ್ಯಾಕ್ಟೀರಿಯಾವನ್ನು ಎರಡು ವಿಧಾನಗಳಲ್ಲಿ ಸಾಯಿಸುವಂತೆ ಮಾಡುತ್ತದೆ.[೬] ಮೊದಲನೆಯದಾಗಿ, ಪ್ರತಿಕಾಯ ಮತ್ತು ಪೂರಕ ಅಣುಗಳ ಬಂಧನವು ಆಪ್ಸೊನೈಸೇಶನ್ ಎನ್ನುವ ಕ್ರಿಯೆಯ ಮೂಲಕ ಫ್ಯಾಗೊಸೈಟ್(ಭಕ್ಷಕ ಕೋಶ)ಗಳು ಆ ಸೂಕ್ಷ್ಮಜೀವಿಯನ್ನು ಅರಗಿಸಿಕೊಳ್ಳುವಂತೆ ಮಾಡುತ್ತದೆ; ಈ ಫ್ಯಾಗೊಸೈಟ್ಗಳನ್ನು ಪೂರಕ ಕಾಸ್ಕೇಡ್ನಲ್ಲಿ ಉತ್ಪತ್ತಿಯಾಗುವ ಕೆಲವು ಪೂರಕ ಅಣುಗಳು ಆಕರ್ಷಿಸುತ್ತವೆ. ಎರಡನೆಯದಾಗಿ, ಬ್ಯಾಕ್ಟೀರಿಯಾಗಳನ್ನು ನೇರವಾಗಿ ಸಾಯಿಸಲು ಪ್ರತಿಕಾಯಗಳಿಗೆ ಸಹಾಯ ಮಾಡಲು ಕೆಲವು ಪೂರಕ ವ್ಯವಸ್ಥೆಯ ಅಂಶಗಳು ಸಂಕೀರ್ಣವಾದ ಪೊರೆಯ ದಾಳಿಯನ್ನು ನಡೆಸುತ್ತವೆ.[೨೨]
ಕಾರ್ಯನಿರ್ವಾಹಕ ಜೀವಕೋಶಗಳ ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆ
[ಬದಲಾಯಿಸಿ]ಜೀವಕೋಶಗಳ ಹೊರಗೆ ನಕಲುಗೊಳ್ಳುವ ರೋಗಕಾರಕಗಳನ್ನು ವಿರೋಧಿಸಲು ಪ್ರತಿಕಾಯಗಳು ರೋಗಕಾರಕಗಳಿಗೆ ಅಂಟಿಕೊಳ್ಳುತ್ತವೆ. ಇದು ಅವು ಕೂಡಿಕೊಳ್ಳುವಂತೆ ಮಾಡುತ್ತದೆ. ಒಂದು ಪ್ರತಿಕಾಯ ಕನಿಷ್ಠ ಎರಡು ಪ್ಯಾರಾಟೋಪ್ಗಳನ್ನು ಹೊಂದಿರುವುದರಿಂದ, ಇದು ಪ್ರತಿಜನಕಗಳ ಮೇಲ್ಮೆಯಲ್ಲಿರುವ ಒಂದೇ ರೀತಿಯ ಎಪಿಟೋಪ್ಗಳನ್ನು ಬಂಧಿಸುವ ಮೂಲಕ ಒಂದಕ್ಕಿಂತ ಹೆಚ್ಚು ಪ್ರತಿಜನಕದೊಂದಿಗೆ ಬಂಧಿಸಬಹುದು. ರೋಗಕಾರಕವನ್ನು ಮುಚ್ಚುವ ಮೂಲಕ, ಪ್ರತಿಕಾಯಗಳು ಅವುಗಳ Fc ಭಾಗವನ್ನು ಗುರುತಿಸುವ ಜೀವಕೋಶಗಳಲ್ಲಿನ ರೋಗಕಾರಕದ ವಿರುದ್ಧ ಕಾರ್ಯನಿರ್ವಾಹಕಗಳ ಕ್ರಿಯೆಗಳನ್ನು ಉತ್ತೇಜಿಸುತ್ತವೆ.[೬]
ಮುಚ್ಚಿದ ರೋಗಕಾರಕಗಳನ್ನು ಗುರುತಿಸುವ ಅಂತಹ ಜೀವಕೋಶಗಳು Fc ಗ್ರಾಹಕಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ, ಅವುಗಳ ಹೆಸರೇ ಸೂಚಿಸುವಂತೆ IgA, IgG ಮತ್ತು IgE ಪ್ರತಿಕಾಯಗಳ Fc ಭಾಗದೊಂದಿಗೆ ಪರಸ್ಪರ ಕ್ರಿಯೆ ನಡೆಸುತ್ತವೆ. ನಿರ್ದಿಷ್ಟ ಜೀವಕೋಶದ ಮೇಲೆ Fc ಗ್ರಾಹಕ ಒಂದಿಗಿನ ನಿರ್ದಿಷ್ಟ ಪ್ರತಿಕಾಯದ ಕೂಡಿಕೊಳ್ಳುವಿಕೆಯು ಆ ಜೀವಕೋಶದ ಕಾರ್ಯನಿರ್ವಾಹಕ ಕ್ರಿಯೆಯನ್ನು ಪ್ರೇರೇಪಿಸುತ್ತದೆ; ಫ್ಯಾಗೊಸೈಟ್ಗಳು ಭಕ್ಷಿಸಿ ನಾಶಪಡಿಸುತ್ತವೆ, ಮಾಸ್ಟ್ ಜೀವಕೋಶಗಳು ಮತ್ತು ನ್ಯೂಟ್ರೊಫಿಲ್ಗಳು ಡಿಗ್ರ್ಯಾನ್ಯುಲೇಟ್ ಆಗುತ್ತವೆ, ಸಹಜವಾಗಿ ಸಾಯಿಸುವ ಜೀವಕೋಶಗಳು ಸೈಟೊಕಿನ್ಗಳು ಮತ್ತು ಸೈಟೊಟಾಕ್ಸಿಕ್ ಅಣುಗಳನ್ನು ಬಿಡುಗಡೆಮಾಡುತ್ತವೆ; ಇದು ಅಂತಿಮವಾಗಿ ಅತಿಕ್ರಮಿಸುವ ಸೂಕ್ಷ್ಮಜೀವಿಯನ್ನು ನಾಶಮಾಡುತ್ತದೆ. Fc ಗ್ರಾಹಕಗಳು ಐಸೊಟೈಪ್-ವಿಶಿಷ್ಟವಾಗಿವೆ, ಇದು ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಗೆ ಹೆಚ್ಚಿನ ನಮ್ಯತೆಯನ್ನು ಒದಗಿಸುತ್ತದೆ ಹಾಗೂ ವಿಭಿನ್ನ ರೋಗಕಾರಕಗಳಿಗೆ ಸೂಕ್ತವಾದ ಪ್ರತಿರಕ್ಷಣಾ ಕ್ರಿಯೆಗಳನ್ನು ನೀಡುತ್ತದೆ.[೩]
ನೈಸರ್ಗಿಕ ಪ್ರತಿಕಾಯಗಳು
[ಬದಲಾಯಿಸಿ]ಮಾನವರು ಮತ್ತು ಮೇಲ್ವರ್ಗದ ಪ್ರೈಮೇಟ್ಗಳು “ನೈಸರ್ಗಿಕ ಪ್ರತಿಕಾಯ”ಗಳನ್ನೂ ಉತ್ಪಾದಿಸುತ್ತವೆ, ಅವು ವೈರಸ್ ಸೋಂಕಿಗಿಂತ ಮೊದಲು ಸೀರಮ್ನಲ್ಲಿರುತ್ತವೆ. ನೈಸರ್ಗಿಕ ಪ್ರತಿಕಾಯಗಳನ್ನು ಪ್ರತಿಕಾಯಗಳೆಂದು ನಿರೂಪಿಸಲಾಗುತ್ತದೆ, ಅವು ಹಿಂದೆ ಯಾವುದೇ ಸೋಂಕು, ವ್ಯಾಕ್ಸಿನೇಶನ್, ಇತರ ಹೊರಗಿನ ಪ್ರತಿಜನಕಗಳಿಗೆ ಒಡ್ಡುವಿಕೆ ಅಥವಾ ನಿಷ್ಕ್ರಿಯ ಪ್ರತಿರಕ್ಷಣೆಯಿಲ್ಲದೆ ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ. ಈ ಪ್ರತಿಕಾಯಗಳು ಕ್ಲಾಸಿಕಲ್ ಪೂರಕ ಪ್ರತಿಕ್ರಿಯಾಸರಣಿಯನ್ನು ಸಕ್ರಿಯಗೊಳಿಸುತ್ತವೆ. ಇದು ಹೊಂದಿಕೊಳ್ಳಬಲ್ಲ ಪ್ರತಿರಕ್ಷಣಾ ಪ್ರತಿಕ್ರಿಯೆಯು ಸಕ್ರಿಯಗೊಳ್ಳುವುದಕ್ಕಿಂತ ಮೊದಲು ಮುಚ್ಚಿದ ವೈರಸ್ ಅಂಶಗಳ ಲೈಸಿಸ್ (ಜೀವಕೋಶದ ವಿಭಜನೆ) ಕ್ರಿಯೆಯು ನಡೆಯುವಂತೆ ಮಾಡುತ್ತದೆ. ಹೆಚ್ಚಿನ ನೈಸರ್ಗಿಕ ಪ್ರತಿಕಾಯಗಳು ಗ್ಲೈಕೊಸಿಲೇಟ್ ಆದ ಜೀವಕೋಶದ ಮೇಲ್ಮೆಯ ಪ್ರೋಟೀನ್ಗಳಲ್ಲಿ ತುದಿಯ ಶರ್ಕರವಾಗಿ ಕಂಡುಬರುವ ಡೈಸ್ಯಾಕರೈಡ್ ಗ್ಯಾಲಕ್ಟೋಸ್ α(1,3)-ಗ್ಯಾಲಕ್ಟೋಸ್ (α-ಗ್ಯಾಲ್)ನ ವಿರುದ್ಧ ನಿರ್ದೇಶಿಸಲ್ಪಡುತ್ತವೆ ಹಾಗೂ ಇವು ಮಾನವನ ಕರುಳಿನಲ್ಲಿರುವ ಬ್ಯಾಕ್ಟೀರಿಯಾದಿಂದ ಉತ್ಪತ್ತಿಯಾಗುವ ಈ ಶರ್ಕರಕ್ಕೆ ಪ್ರತಿಕ್ರಿಯೆಯಾಗಿ ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ.[೨೩] ಕ್ಸೆನೊಟ್ರಾನ್ಸ್ಪ್ಲಾಂಟೇಟ್ ಆದ ಅಂಗಗಳ ತಳ್ಳಿಹಾಕುವಿಕೆಯು, ಗ್ರಾಹಕ ಅಂಗಾಶದ ಸೀರಮ್ನಲ್ಲಿ ಪರಿಚಲನೆಯಾಗುವ ನೈಸರ್ಗಿಕ ಪ್ರತಿಕಾಯಗಳು ಕೊಡುವ ಅಂಗಾಶದಲ್ಲಿರುವ α-ಗ್ಯಾಲ್ ಪ್ರತಿಜನಕಗಳೊಂದಿಗೆ ಬಂಧಿಸಲ್ಪಡುವುದರ ಪರಿಣಾಮವಾಗಿ ಉಂಟಾಗುತ್ತದೆಂದು ಹೇಳಲಾಗುತ್ತದೆ.[೨೪]
ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ವೈವಿಧ್ಯತೆ(ಪ್ರತಿಕಾಯದ ಪ್ರತಿಕ್ರಿಯೆಯ ವಿವಿಧತೆ)
[ಬದಲಾಯಿಸಿ]ವಾಸ್ತವವಾಗಿ ಎಲ್ಲಾ ಸೂಕ್ಷ್ಮಜೀವಿಗಳು ಪ್ರತಿಕಾಯದ ಪ್ರತಿಕ್ರಿಯೆಯನ್ನು ಉತ್ತೇಜಿಸಬಲ್ಲವು. ವಿವಿಧ ರೀತಿಯ ಸೂಕ್ಷ್ಮಜೀವಿಗಳನ್ನು ಗುರುತಿಸಿ ಯಶಸ್ವಿಯಾಗಿ ನಾಶ ಮಾಡಲು ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಭಿನ್ನತೆಯಿರಬೇಕಾಗುತ್ತದೆ; ಅವುಗಳ ಅಮೈನೊ ಆಮ್ಲ ಸಂಯೋಜನೆಯ ಭಿನ್ನತೆಯು ಅವುಗಳನ್ನು ವಿವಿಧ ರೀತಿಯ ಪ್ರತಿಜನಕಗಳೊಂದಿಗೆ ಪರಸ್ಪರ ಕ್ರಿಯೆ ನಡೆಸುವಂತೆ ಮಾಡುತ್ತದೆ.[೨೫] ಮಾನವರಲ್ಲಿ ಸುಮಾರು 10 ಶತಕೋಟಿ ಪ್ರಕಾರದ ಪ್ರತಿಕಾಯಗಳು ಉತ್ಪತ್ತಿಯಾಗುತ್ತವೆ ಎಂದು ಅಂದಾಜಿಸಲಾಗಿದೆ. ಈ ಪ್ರತಿಯೊಂದು ಪ್ರತಿಕಾಯಗಳು ಪ್ರತಿಜನಕವೊಂದರ ವಿವಿಧ ಎಪಿಟೋಪ್ಗಳೊಂದಿಗೆ ಬಂಧಿಸುವ ಸಾಮರ್ಥ್ಯ ಹೊಂದಿರುತ್ತವೆ.[೨೬] ಪ್ರತಿಯೊಬ್ಬರಲ್ಲಿ ವಿವಿಧ ರೀತಿಯ ಅನೇಕ ಪ್ರತಿಕಾಯಗಳು ಉತ್ಪತ್ತಿಯಾದರೂ, ಈ ಪ್ರೋಟೀನ್ಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡಲು ಲಭ್ಯವಾಗಿರುವ ಜೀನ್ಗಳ ಪ್ರಮಾಣವು ಮಾನವನ ಜೀನೋಮ್ನ ಸಂಖ್ಯೆಯಿಂದ ಮಿತಿಗೊಳ್ಳುತ್ತದೆ. ಅನೇಕ ಸಂಕೀರ್ಣ ಜೀನ್-ಸಂಬಂಧಿತ ಕಾರ್ಯವಿಧಾನಗಳು ಕಂಡುಬರುತ್ತವೆ, ಅವು ಕಶೇರುಕ B ಜೀವಕೋಶಗಳು ಕಡಿಮೆ ಸಂಖ್ಯೆಯ ಪ್ರತಿಕಾಯ ಜೀನ್ಗಳಿಂದ ವಿಭಿನ್ನ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪಾದಿಸುವಂತೆ ಮಾಡುತ್ತವೆ.[೨೭]
ಡೊಮೇನ್ (ಪ್ರಭಾವಿತವಲಯದಲ್ಲಿನ) ವ್ಯತ್ಯಾಸ
[ಬದಲಾಯಿಸಿ]
ಪ್ರತಿಕಾಯವನ್ನು ಸಂಕೇತಿಸುವ ಕ್ರೋಮೊಸೋಮ್ನ ಭಾಗವು ದೊಡ್ಡದಾಗಿರುತ್ತದೆ.ಅಲ್ಲದೇ ಪ್ರತಿಕಾಯದ ಪ್ರತಿಯೊಂದು ಡೊಮೇನ್ಗಾಗಿ ಅನೇಕ ವಿಭಿನ್ನ ಜೀನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತದೆ. ಮಾನವರಲ್ಲಿ ದೀರ್ಘ ಸರಪಣಿ ಜೀನ್ಗಳನ್ನು (IGH@) ಹೊಂದಿರುವ ಭಾಗವು 14ನೇ ಕ್ರೋಮೊಸೋಮ್ನಲ್ಲಿ ಹಾಗೂ ಲ್ಯಾಂಬ್ಡಾ ಮತ್ತು ಕಪ್ಪ ಸರಳ ಸರಪಣಿ ಜೀನ್ಗಳನ್ನು (IGL@ ಮತ್ತು IGK@) ಒಳಗೊಂಡ ಭಾಗಗಳು 22 ಮತ್ತು 2ನೇ ಕ್ರೋಮೊಸೋಮ್ಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ. ಈ ಡೊಮೇನ್ಗಳಲ್ಲಿ ಒಂದನ್ನು ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇದು ಪ್ರತಿಯೊಂದು ಪ್ರತಿಕಾಯದ ಪ್ರತಿಯೊಂದು ದೀರ್ಘ ಮತ್ತು ಸರಳ ಸರಪಣಿಯಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ, ಆದರೆ ವಿಭಿನ್ನ B ಜೀವಕೋಶಗಳಿಂದ ಉತ್ಪತ್ತಿಯಾದ ವಿವಿಧ ಪ್ರತಿಕಾಯಗಳಲ್ಲಿ ಭಿನ್ನವಾಗಿರುತ್ತದೆ. ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ಗಳ ಭಿನ್ನತೆಯು ಹೈಪರ್ವೇರಿಯೇಬಲ್(ಅತಿಹೆಚ್ಚಾಗಿ-ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ) ಬಾಗಗಳೆಂದು ಕರೆಯುವ ಮೂರು ಲೂಪ್ಗಳಲ್ಲಿ (HV-1, HV-2 ಮತ್ತು HV-3) ಅಥವಾ ಕಾಂಪ್ಲಿಮೆಂಟಾರಿಟಿ ಡಿಟರ್ಮೈನಿಂಗ್(ಪೂರಕ ಅಂಶಗಳನ್ನು ಕಂಡುಹಿಡಿಯುವ) ಭಾಗಗಳಲ್ಲಿ (CDR1, CDR2 ಮತ್ತು CDR3) ಕಂಡುಬರುತ್ತದೆ. CDR ಗಳು ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ನಲ್ಲಿ ರಕ್ಷಿತ ಆಧಾರ ಭಾಗಗಳಿಂದ ಬೆಂಬಲವನ್ನು ಪಡೆಯುತ್ತವೆ. ದೀರ್ಘ ಸರಪಣಿ ಭಾಗವು ಸುಮಾರು 65 ವಿವಿಧ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ ಜೀನ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ, ಅವೆಲ್ಲವೂ ಅವುಗಳ CDR ಗಳಲ್ಲಿ ಭಿನ್ನವಾಗಿರುತ್ತವೆ. ಪ್ರತಿಕಾಯದ ಇತರ ಡೊಮೇನ್ಗಳ ಜೀನ್ಗಳೊಂದಿಗಿನ ಈ ಜೀನ್ಗಳ ಸೇರಿಕೆಯು ಅತಿ ಹೆಚ್ಚಿನ ವಿವಿಧತೆಯೊಂದಿಗೆ ವಿಭಿನ್ನ ಪ್ರತಿಕಾಯಗಳ ಉತ್ಪತ್ತಿಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಈ ಸಂಯೋಗವನ್ನು V(D)J ಪುನಃಸಂಯೋಗವೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಇದನ್ನು ಈ ಕೆಳಗೆ ವಿವರಿಸಲಾಗಿದೆ.[೨೮]
V(D)J ಪುನಃಸಂಯೋಗ
[ಬದಲಾಯಿಸಿ]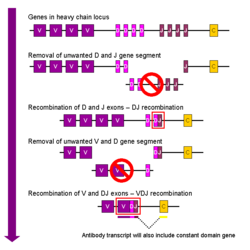
V(D)J ಪುನಃಸಂಯೋಗ ವೆಂದೂ ಕರೆಯುವ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ನ ಶಾರೀರಿಕ ಪುನಃಸಂಯೋಜನೆಯು ಒಂದು ಭಿನ್ನ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗವನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತದೆ. ಪ್ರತಿಯೊಂದು ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ದೀರ್ಘ ಅಥವಾ ಸರಳ ಸರಪಣಿಯ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗವು ಜೀನ್-ಚೂರುಗಳೆಂದು ಕರೆಯುವ ಅನೇಕ ಭಾಗಗಳಲ್ಲಿ ಸಂಕೇತಿಸಲ್ಪಡುತ್ತದೆ. ಈ ಭಾಗಗಳನ್ನು ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ(ವೇರಿಯೇಬಲ್) (V), ಭಿನ್ನತೆ(ಡೈವರ್ಸಿಟಿ) (D) ಮತ್ತು ಸೇರುವ(ಜಾಯ್ನಿಂಗ್) (J) ಭಾಗಗಳೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ.[೨೭] V, D ಮತ್ತು J ಭಾಗಗಳು Ig ದೀರ್ಘ ಸರಪಣಿಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ, ಆದರೆ ಕೇವಲ V ಮತ್ತು J ಭಾಗಗಳು ಮಾತ್ರ Ig ಸರಳ ಸರಪಣಿಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ. V, D ಮತ್ತು J ಜೀನ್ ಭಾಗಗಳ ಹಲವಾರು ನಕಲುಗಳು ಕಂಡುಬರುತ್ತವೆ.ಅಲ್ಲದೇ ಅವು ಸಸ್ತನಿಗಳ(ವಂಶವಾಹಿನಿಯಲ್ಲಿ) ಜೀನೋಮ್ಗಳಲ್ಲಿ ಜೊತೆಯಾಗಿ ಜೋಡಿಸಲ್ಪಟ್ಟಿರುತ್ತವೆ. ಮೂಳೆಯ ಮಜ್ಜೆಯಲ್ಲಿ, ಪ್ರತಿಯೊಂದು ಬೆಳೆಯುತ್ತಿರುವ B ಜೀವಕೋಶವು ಒಂದು V, ಒಂದು D ಮತ್ತು ಒಂದು J ಜೀನ್ ಭಾಗವನ್ನು (ಅಥವಾ ಸರಳ ಸರಪಣಿಯಲ್ಲಿ ಒಂದು V ಮತ್ತು ಒಂದು J ಭಾಗ) ಯಾದೃಚ್ಛಿಕವಾಗಿ ಆರಿಸಿ ಒಂದುಗೂಡಿಸುವ ಮೂಲಕ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗವೊಂದನ್ನು ಕಲೆಹಾಕುತ್ತದೆ. ಪ್ರತಿಯೊಂದು ಪ್ರಕಾರದ ಜೀನ್ ಭಾಗದಲ್ಲಿ ಅನೇಕ ನಕಲುಗಳಿರುವುದರಿಂದ ಹಾಗೂ ಪ್ರತಿಯೊಂದು ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್-ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗವನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡಲು ವಿವಿಧ ಸಂಯೋಜನೆಗಳ ಜೀನ್ ಭಾಗಗಳನ್ನು ಬಳಸುವುದರಿಂದ, ಈ ಕ್ರಿಯೆಯು ಅಸಂಖ್ಯಾತ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತದೆ. ಪ್ರತಿಯೊಂದು ವಿವಿಧ ಪ್ಯಾರಾಟೋಪ್ಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.ಅಲ್ಲದೇ ಆ ಮೂಲಕ ವಿವಿಧ ಪ್ರತಿಜನಕ ನಿರ್ದಿಷ್ಟ ಲಕ್ಷಣಗಳನ್ನೂ ಹೊಂದಿರುತ್ತವೆ.[೨]
B ಜೀವಕೋಶವು V(D)J ಪುನಃಸಂಯೋಗದ ಸಂದರ್ಭದಲ್ಲಿ ಒಂದು ಕ್ರಿಯಾತ್ಮಕ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಜೀನ್ಅನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡಿದ ನಂತರ, ಅದು ಯಾವುದೇ ಇತರ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗವನ್ನು ವ್ಯಕ್ತಪಡಿಸುವುದಿಲ್ಲ. (ಈ ಕ್ರಿಯೆಯನ್ನು ಅಲೆಲಿಕ್ ಎಕ್ಸ್ಕ್ಲೂಷನ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ). ಆದ್ದರಿಂದ ಪ್ರತಿಯೊಂದು B ಜೀವಕೋಶವು ಕೇವಲ ಒಂದು ರೀತಿಯ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಸರಪಣಿಯನ್ನು ಹೊಂದಿರುವ ಪ್ರತಿಕಾಯಗಳನ್ನು ಮಾತ್ರ ಉತ್ಪತ್ತಿ ಮಾಡಬಲ್ಲವು.[೩][೨೯]
ಸೊಮ್ಯಾಟಿಕ್ ಹೈಪರ್ಮ್ಯುಟೇಶನ್(ಶಾರೀರಿಕ ಅತಿಹೆಚ್ಚಿನ ಪರಿವರ್ತನೆ) ಮತ್ತು ಆಕರ್ಷಣ ಬಲ ಹೆಚ್ಚುವಿಕೆ,ಪ್ರೌಢತೆ(ಅಫಿನಿಟಿ ಮ್ಯಾಚುರೇಶನ್)
[ಬದಲಾಯಿಸಿ]- ಈ ವಿಷಯದ ಬಗೆಗಿನ ಹೆಚ್ಚಿನ ವಿವರಗಳಿಗಾಗಿ, ಸೊಮ್ಯಾಟಿಕ್ ಹೈಪರ್ಮ್ಯುಟೇಶನ್ ಮತ್ತು ಆಕರ್ಷಣ ಬಲದ ಹೆಚ್ಚಳ ವನ್ನು ಗಮನಿಸಿ.
ಪ್ರತಿಜನಕದೊಂದಿಗೆ ಸಕ್ರಿಯಗೊಂಡ ನಂತರ B ಜೀವಕೋಶಗಳು ಅತಿಶೀಘ್ರವಾಗಿ ವಿಭಜನೆಯಾಗಲು ಆರಂಭವಾಗುತ್ತವೆ. ಈ ಅತಿಶೀಘ್ರವಾಗಿ ವಿಭಜನೆಯಾಗುವ ಜೀವಕೋಶಗಳಲ್ಲಿ, ದೀರ್ಘ ಮತ್ತು ಸರಳ ಸರಪಣಿಗಳ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ಗಳನ್ನು ಸಂಕೇತಿಸುವ ಜೀನ್ಗಳು ಸೊಮ್ಯಾಟಿಕ್ ಹೈಪರ್ಮ್ಯುಟೇಶನ್ (SHM) ಎನ್ನುವ ಕ್ರಿಯೆಯ ಮೂಲಕ ಅತಿ ಹೆಚ್ಚಿನ ದರ ಪ್ರಮಾಣದ(ಅಂಶಗಳಿಗೆ) ಪಾಯಿಂಟ್ ರೂಪಾಂತರಕ್ಕೆ ಒಳಗಾಗುತ್ತವೆ. SHM ಪ್ರತಿಯೊಂದು ಜೀವಕೋಶ ವಿಭಜನೆಯಲ್ಲಿ ಪ್ರತಿಯೊಂದು ಜೀನ್ನ ರೂಪಾಂತರಕ್ಕೆ ಸರಿಸುಮಾರು ಒಂದು ನ್ಯೂಕ್ಲಿಯೊಟೈಡ್ ಬದಲಾಗುವಂತೆ ಮಾಡುತ್ತದೆ.[೫] ಇದರ ಪರಿಣಾಮವಾಗಿ, ಮರಿ-B ಜೀವಕೋಶಗಳು ಅವುಗಳ ಪ್ರತಿಕಾಯ ಸರಪಣಿಗಳ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ಗಳಲ್ಲಿ ಸ್ವಲ್ಪ ಭಿನ್ನವಾದ ಅಮೈನೊ ಆಮ್ಲಗಳನ್ನು ಹೊಂದುತ್ತವೆ.
ಇದು ಪ್ರತಿಕಾಯ ಸಮೂಹದಲ್ಲಿ ಭಿನ್ನತೆಯು ಹೆಚ್ಚಾಗುವಂತೆ ಮಾಡುತ್ತದೆ. ಜೊತೆಗೆ ಪ್ರತಿಕಾಯದ ಪ್ರತಿಜನಕ-ಬಂಧಿಸುವ ಆಕರ್ಷಣ ಬಲದ ಮೇಲೆ ಪರಿಣಾಮ ಬೀರುತ್ತದೆ.[೩೦] ಕೆಲವು ಪಾಯಿಂಟ್ ರೂಪಾಂತರಗಳು ಮೂಲ ಪ್ರತಿಕಾಯಕ್ಕಿಂತ ಅವುಗಳ ಪ್ರತಿಜನಕದೊಂದಿಗೆ ದುರ್ಬಲ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು (ಕಡಿಮೆ ಆಕರ್ಷಣೆ ಬಲ) ಹೊಂದಿರುವ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತವೆ. ಅದೇ ಕೆಲವು ಪಾಯಿಂಟ್ ರೂಪಾಂತರಗಳು ಪ್ರಬಲ ಪರಸ್ಪರ ಕ್ರಿಯೆಯನ್ನು (ಹೆಚ್ಚು ಆಕರ್ಷಣೆ ಬಲ) ಹೊಂದಿರುವ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತವೆ.[೩೧] ಮೇಲ್ಮೆಯಲ್ಲಿ ಹೆಚ್ಚಿನ ಆಕರ್ಷಣೆ ಬಲದ ಪ್ರತಿಕಾಯಗಳನ್ನು ಹೊಂದಿರುವ B ಜೀವಕೋಶಗಳು ಇತರ ಜೀವಕೋಶಗಳೊಂದಿಗಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳ ಸಂದರ್ಭದಲ್ಲಿ ಪ್ರಬಲವಾದ ಉಳಿಯುವ ಸಂಕೇತವನ್ನು ಪಡೆಯುತ್ತವೆ. ಅದೇ ಕಡಿಮೆ ಆಕರ್ಷಣೆ ಬಲದ ಪ್ರತಿಕಾಯಗಳನ್ನು ಒಳಗೊಂಡಿರುವಂತಹವು ಇದನ್ನು ಪಡೆಯುವುದಿಲ್ಲ ಹಾಗೂ ಅವು ಅಪೋಪ್ಟೋಸಿಸ್ನಿಂದಾಗಿ ಸಾಯುತ್ತವೆ.[೩೧] ಆದ್ದರಿಂದ ಪ್ರತಿಜನಕಕ್ಕೆ ಹೆಚ್ಚು ಆಕರ್ಷಣ ಬಲವನ್ನು ವ್ಯಕ್ತಪಡಿಸುವ ಪ್ರತಿಕಾಯಗಳನ್ನು ಹೊಂದಿರುವ B ಜೀವಕೋಶಗಳು ಕ್ರಿಯೆ ಮತ್ತು ಉಳಿಯುವಿಕೆಯಲ್ಲಿ ದುರ್ಬಲ ಆಕರ್ಷಣ ಬಲವನ್ನು ಹೊಂದಿರುವವುಗಳನ್ನು ಮೀರಿಸುತ್ತವೆ. ಹೆಚ್ಚಿನ ಬಂಧಿಸುವ ಆಕರ್ಷಣ ಬಲವನ್ನು ಹೊಂದಿರುವ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವ ಕ್ರಿಯೆಯನ್ನು ಆಕರ್ಷಣ ಬಲದ ಹೆಚ್ಚಳ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಆಕರ್ಷಣ ಬಲದ ಹೆಚ್ಚಿಸುವಿಕೆಯು V(D)J ಪುನಃಸಂಯೋಗದ ನಂತರ ಬೆಳೆದ B ಜೀವಕೋಶಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ.ಅಲ್ಲದೇ ಇದು ನೆರವಿಗಾಗಿ ಸಹಾಯಕ T ಜೀವಕೋಶಗಳನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ.[೩೨]
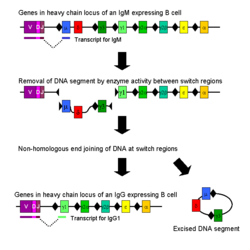
ಕ್ಲಾಸ್ ಸ್ವಿಚಿಂಗ್ (ಜೈವಿಕ ಪ್ರಕ್ರಿಯೆ)
[ಬದಲಾಯಿಸಿ]ಐಸೊಟೈಪ್ ಅಥವಾ ಕ್ಲಾಸ್ ಸ್ವಿಚಿಂಗ್ B ಜೀವಕೋಶದ ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆಯ ನಂತರ ಕಂಡುಬರುವ ಒಂದು ಜೈವಿಕ ಕ್ರಿಯೆಯಾಗಿದೆ. ಇದು ಜೀವಕೋಶವು ವಿವಿಧ ವರ್ಗದ ಪ್ರತಿಕಾಯಗಳನ್ನು (IgA, IgE ಅಥವಾ IgG) ಉತ್ಪತ್ತಿ ಮಾಡುವಂತೆ ಮಾಡುತ್ತದೆ.[೨] ಪ್ರತಿಕಾಯದ ವಿವಿಧ ವರ್ಗಗಳು ಮತ್ತು ಕಾರ್ಯನಿರ್ವಾಹಕ ಕ್ರಿಯೆಗಳನ್ನು ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ದೀರ್ಘ ಸರಪಣಿಯ ಸ್ಥಿರ (C) ಭಾಗಗಳಿಂದ ನಿರೂಪಿಸಲಾಗುತ್ತದೆ. ಆರಂಭಿಕವಾಗಿ, ನೈವ್ B ಜೀವಕೋಶಗಳು ಕೇವಲ ಜೀವಕೋಶ-ಮೇಲ್ಮೈ IgM ಮತ್ತು IgD ಅನ್ನು ಒಂದೇ ರೀತಿಯ ಪ್ರತಿಜನಕ ಬಂಧಿಸುವ ಭಾಗಗಳೊಂದಿಗೆ ವ್ಯಕ್ತಪಡಿಸುತ್ತವೆ. ಪ್ರತಿಯೊಂದು ಐಸೊಟೈಪ್ಅನ್ನು ಒಂದು ವಿಭಿನ್ನ ಕ್ರಿಯೆಗೆ ಹೊಂದಿಸಲಾಗುತ್ತದೆ. ಆದ್ದರಿಂದ ಸಕ್ರಿಯಗೊಳಿಸುವಿಕೆಯ ನಂತರ ಪ್ರತಿಜನಕವನ್ನು ಹೊರಹಾಕಲು IgG, IgA ಅಥವಾ IgE ಕಾರ್ಯನಿರ್ವಾಹಕ ಕ್ರಿಯೆಯೊಂದಿಗೆ ಒಂದು ಪ್ರತಿಕಾಯವು ಬೇಕಾಗುತ್ತದೆ. ಕ್ಲಾಸ್ ಸ್ವಿಚಿಂಗ್ ಒಂದೇ ಸಕ್ರಿಯ B ಜೀವಕೋಶದ ಬೇರೆ ಬೇರೆ ಮರಿ ಜೀವಕೋಶಗಳು ವಿವಿಧ ಐಸೊಟೈಪ್ಗಳ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವಂತೆ ಮಾಡುತ್ತದೆ. ಕ್ಲಾಸ್ ಸ್ವಿಚಿಂಗ್ನ ಸಂದರ್ಭದಲ್ಲಿ ಪ್ರತಿಕಾಯ ದೀರ್ಘ ಸರಪಣಿಯ ಕೇವಲ ಸ್ಥಿರ ಭಾಗ ಮಾತ್ರ ಬದಲಾಗುತ್ತದೆ; ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗ ಮತ್ತು ಪ್ರತಿಜನಕ ನಿರ್ದಿಷ್ಟ ಲಕ್ಷಣವು ಬದಲಾಗದೆ ಹಾಗೆಯೇ ಉಳಿಯುತ್ತದೆ. ಆದ್ದರಿಂದ ಒಂದು B ಜೀವಕೋಶದ ಮರಿ ಜೀವಕೋಶಗಳು ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತವೆ, ಎಲ್ಲವೂ ಒಂದೇ ಪ್ರತಿಜನಕಕ್ಕೆ ನಿರ್ದಿಷ್ಟವಾಗಿರುತ್ತವೆ, ಆದರೆ ಪ್ರತಿಜನಕವನ್ನು ವಿರೋಧಿಸುವ ಕಾರ್ಯನಿರ್ವಾಹಕ ಕ್ರಿಯೆಯನ್ನು ಉಂಟುಮಾಡುವ ಸಾಮರ್ಥ್ಯ ಹೊಂದಿರುತ್ತವೆ. ಕ್ಲಾಸ್ ಸ್ವಿಚಿಂಗ್ ಕ್ರಿಯೆಯು ಸೈಟೊಕಿನ್ಗಳಿಂದ ಪ್ರಚೋದಿಸಲ್ಪಡುತ್ತದೆ; ಉತ್ಪತ್ತಿಯಾಗುವ ಐಸೊಟೈಪ್ B ಜೀವಕೋಶದಲ್ಲಿರುವ ಸೈಟೊಕಿನ್ಗಳನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ.[೩೩]
ಕ್ಲಾಸ್ ಸ್ವಿಚಿಂಗ್, ದೀರ್ಘ ಸರಪಣಿ ಜೀನ್ ಭಾಗದಲ್ಲಿ ಕ್ಲಾಸ್ ಸ್ವಿಚ್ ರಿಕಾಂಬಿನೇಶನ್ (CSR) ಎಂಬ ಕ್ರಿಯೆಯಿಂದ ಕಂಡುಬರುತ್ತದೆ. ಈ ಕ್ರಿಯೆಯು ಸ್ವಿಚ್ (S) ಬಾಗಗಳು ಎನ್ನುವ ರಕ್ಷಿತ ನ್ಯೂಕ್ಲಿಯೊಟೈಡ್ನ ವಿಶಿಷ್ಟ ಲಕ್ಷಣಗಳನ್ನು ಅವಲಂಬಿಸಿರುತ್ತದೆ, ಇದು ಪ್ರತಿಯೊಂದು ಸ್ಥಿರ ಭಾಗದ ಜೀನ್ನ (δ-ಸರಪಣಿಯನ್ನು ಹೊರತುಪಡಿಸಿ) DNA ಪ್ರವಾಹದಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ. DNA ಸ್ಟ್ರ್ಯಾಂಡ್, ಎರಡು ಆಯ್ದ S-ಭಾಗಗಳಲ್ಲಿ ಅನೇಕ ಕಿಣ್ವಗಳ ಕ್ರಿಯಾತ್ಮಕತೆಯಿಂದ ವಿಭಜಿಸಲ್ಪಡುತ್ತದೆ.[೩೪][೩೫] ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಡೊಮೇನ್ ಎಕ್ಸಾನ್, ನಾನ್-ಹೋಮೊಲಾಗಸ್ ಎಂಡ್ ಜಾಯ್ನಿಂಗ್ (NHEJ) ಎಂಬ ಕ್ರಿಯೆಯ ಮೂಲಕ ಅಪೇಕ್ಷಿತ ಸ್ಥಿರ ಭಾಗದೊಂದಿಗೆ (γ, α or ε) ಮತ್ತೆ ಒಂದುಗೂಡುತ್ತದೆ. ಈ ಕ್ರಿಯೆಯು ವಿವಿಧ ಐಸೊಟೈಪ್ನ ಪ್ರತಿಕಾಯವನ್ನು ಸಂಕೇತಿಸುವ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಜೀನ್ಅನ್ನು ಉತ್ಪತ್ತಿಮಾಡುತ್ತದೆ.[೩೬]
ವೈದ್ಯಕೀಯ ಪ್ರಯೋಜನಗಳು
[ಬದಲಾಯಿಸಿ]ರೋಗ ಲಕ್ಷಣ ಗುರುತಿಸುವಿಕೆ ಮತ್ತು ಚಿಕಿತ್ಸೆ
[ಬದಲಾಯಿಸಿ]ನಿರ್ದಿಷ್ಟ ಪ್ರತಿಕಾಯಗಳ ಗುರುತಿಸುವಿಕೆಯು ವೈದ್ಯಕೀಯ ರೋಗ ನಿರ್ಣಯಿಸುವುದರಲ್ಲಿ ಒಂದು ಸಾಮಾನ್ಯ ರೀತಿಯಾಗಿದೆ. ಅದು ಸೀರಮ್ ಶಾಸ್ತ್ರದಂತಹ ಅನ್ವಯಗಳು ಈ ವಿಧಾನಗಳನ್ನು ಅವಲಂಬಿಸಿರುತ್ತವೆ.[೩೭] ಉದಾಹರಣೆಗಾಗಿ, ಜೈವಿಕ-ರಾಸಾಯನಿಕ ವಿಶ್ಲೇಷಣೆಯಲ್ಲಿ ರೋಗ ಲಕ್ಷಣ ಗುರುತಿಸಲು[೩೮] ಎಪ್ಸ್ಟೈನ್-ಬಾರ್ ವೈರಸ್ ಅಥವಾ ಲೈಮ್ ರೋಗದ ವಿರುದ್ಧ ಪ್ರತಿಕಾಯಗಳ ಒಂದು ಟೈಟರ್ಅನ್ನು ನಿರ್ದೇಶಿಸಲಾಗುತ್ತದೆ, ಇದನ್ನು ರಕ್ತದಿಂದ ಪಡೆಯಲಾಗುತ್ತದೆ. ಅಂತಹ ಪ್ರತಿಕಾಯಗಳು ಇಲ್ಲದಿದ್ದರೆ, ವ್ಯಕ್ತಿಯು ಸೋಂಕಿಗೆ ಒಳಗಾಗಿಲ್ಲ ಅಥವಾ ಸೋಂಕು ಬಹಳ ಹಿಂದೆ ಕಂಡುಬಂದಿತ್ತು ಎಂದರ್ಥ. ಈ ನಿರ್ದಿಷ್ಟ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವ B ಜೀವಕೋಶಗಳು ನೈಸರ್ಗಿಕವಾಗಿ ನಶಿಸಿಹೋಗಿವೆ. ಪ್ರಾಯೋಗಿಕ ಪ್ರತಿರಕ್ಷಾ ಶಾಸ್ತ್ರದಲ್ಲಿ, ರೋಗಿಯ ಪ್ರತಿಕಾಯದ ಪ್ರಮಾಣವನ್ನು ನಿರೂಪಿಸಲು ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ನಗಳ ಪ್ರತಿಯೊಂದು ವರ್ಗಗಳ ಮಟ್ಟಗಳನ್ನು ನೆಫೆಲೊಮೆಟ್ರಿ (ಅಥವಾ ಟರ್ಬಿಡಿಮೆಟ್ರಿ)ಯಿಂದ ಅಂದಾಜಿಸಲಾಗುತ್ತದೆ.[೩೯] ರೋಗನಿರ್ಣಯವು ಸ್ಪಷ್ಟವಾಗಿರದ ರೋಗಿಗಳ ಪಿತ್ತಜನಕಾಂಗದ ಹಾನಿಯ ಕಾರಣವನ್ನು ಕಂಡುಹಿಡಿಯುವಲ್ಲಿ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ಗಳ ವಿವಿಧ ವರ್ಗಗಳಲ್ಲಿನ ಉತ್ಕರ್ಷಣೆಯು ಕೆಲವೊಮ್ಮೆ ಉಪಯುಕ್ತವಾಗಿರುತ್ತದೆ.[೪] ಉದಾಹರಣೆಗಾಗಿ, ಉತ್ಕರ್ಷಗೊಳಿಸಿದ IgA ಆಲ್ಕಹಾಲಿಕ ಸಿರೋಸಿಸ್ಅನ್ನು ಸೂಚಿಸುತ್ತದೆ, ಉತ್ಕರ್ಷಗೊಳಿಸಿದ IgM ವೈರಸ್-ಹೆಪಟೈಟಿಸ್ ಮತ್ತು ಪ್ರಾಥಮಿಕ ಪಿತ್ತರಸದ-ಸಿರೋಸಿಸ್ಅನ್ನು ಸೂಚಿಸುತ್ತದೆ. IgG ಅನ್ನು ವೈರಲ್-ಹೆಪಟೈಟಿಸ್, ಆಟೊಇಮ್ಯೂನ್ ಹೆಪಟೈಟಿಸ್ ಮತ್ತು ಸಿರೋಸಿಸ್ನಲ್ಲಿ ಉತ್ಕರ್ಷಗೊಳಿಸಲಾಗುತ್ತದೆ. ಆಟೊಇಮ್ಯೂನ್ ಕಾಯಿಲೆಗಳನ್ನು ಹೆಚ್ಚಾಗಿ ದೇಹದ ಎಪಿಟೋಪ್ಗಳನ್ನೇ ಬಂಧಿಸುವ ಪ್ರತಿಕಾಯಗಳಿಂದ ಪತ್ತೆಹಚ್ಚಲಾಗುತ್ತದೆ; ಹೆಚ್ಚಿನವನ್ನು ರಕ್ತ ಪರೀಕ್ಷೆಯ ಮೂಲಕ ಕಂಡುಹಿಡಿಯಲಾಗುತ್ತದೆ. ಪ್ರತಿರಕ್ಷಣಾ ಮಧ್ಯಸ್ಥಿಕೆಯ ಹೀಮೊಲಿಟಿಕ್ ಅನೀಮಿಯದಲ್ಲಿ ಕೆಂಪು ರಕ್ತಕಣ ಮೇಲ್ಮೈ ಪ್ರತಿಜನಕಗಳ ವಿರುದ್ಧ ನಿರ್ದೇಶಿಸುವ ಪ್ರತಿಕಾಯಗಳನ್ನು(ಎರಡು ಪ್ರಯೋಗಾಲಯದಲ್ಲಿ ಏಕಕಾಲಕ್ಕೆ ಪರೀಕ್ಷೆಗೆ ಒಳಪಡಿಸುವಿಕೆ) ಕೂಂಬ್ಸ್ ಪರೀಕ್ಷೆಯ ಮೂಲಕ ಪತ್ತೆ ಹಚ್ಚಲಾಗುತ್ತದೆ.[೪೦] ಕೂಂಬ್ಸ್ ಪರೀಕ್ಷೆಯನ್ನು ರಕ್ತ ವರ್ಗಾವಣೆಯ ತಯಾರಿಯಲ್ಲಿ ಹಾಗೂ ಪ್ರಸವಪೂರ್ವ ಮಹಿಳೆಯರಲ್ಲಿ ಪ್ರತಿಕಾಯವನ್ನು ಪರೀಕ್ಷಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ.[೪೦] ಪ್ರಾಯೋಗಿಕವಾಗಿ, ಸಂಕೀರ್ಣ ಪ್ರತಿಜನಕ-ಪ್ರತಿಕಾಯದ ಪತ್ತೆಹಚ್ಚುವಿಕೆಯನ್ನು ಆಧರಿಸಿದ ಅನೇಕ ಪ್ರತಿರಕ್ಷಣಾ-ರೋಗನಿರ್ಣಯ ಮಾಡುವ ವಿಧಾನಗಳನ್ನು ಸಾಂಕ್ರಾಮಿಕ ಕಾಯಿಲೆಗಳನ್ನು ಪತ್ತೆಹಚ್ಚಲು ಬಳಸಲಾಗುತ್ತದೆ, ಉದಾಹರಣೆಗಾಗಿ - ELISA, ಇಮ್ಯುನೊಫ್ಲೋರೆಸೆನ್ಸ್, ವೆಸ್ಟರ್ನ್ ಬ್ಲಾಟ್, ಇಮ್ಯುನೊಡಿಫ್ಯೂಜನ್, ಇಮ್ಯುನೊಎಲೆಕ್ಟ್ರೊಫೋರೆಸಿಸ್ ಮತ್ತು ಮ್ಯಾಗ್ನೆಟಿಕ್ ಇಮ್ಯುನಸೆ.(ವಿವಿಧ ಹಂತಗಳಲ್ಲಿ ರೋಗ ನಿರೋಧಕ ಶಕ್ತಿಯನ್ನು ಪ್ರಮಾಣಿಕರಿಸುವುದು.) ಮಾನವನ ಕೋರಿಯಾನಿಕ್ ಗೊನಾಡೊಟ್ರೋಪಿನ್ನ ವಿರುದ್ಧ ಉತ್ಪತ್ತಿಯಾಗುವ ಪ್ರತಿಕಾಯಗಳನ್ನು ಗರ್ಭಿಣಿಯರ ಪರೀಕ್ಷೆಗಳಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಉದ್ದಿಷ್ಟ ಏಕಕ್ಲೋನೀಯ ಪ್ರತಿಕಾಯ ಚಿಕಿತ್ಸೆಯನ್ನು, ಸಂಧಿವಾತ,[೪೧] ಮಲ್ಟಿಪಲ್ ಸ್ಕ್ಲೈರೋಸಿಸ್(ಪಾರ್ಶ್ವವಾಯುವಿನಂತಹ ಕಾಯಿಲೆಗಳಿಗೆ ಎಡೆಮಾಡಿಕೊಡುವ ನರಸಂಬಂಧಿ ಕಾಯಿಲೆ),[೪೨] ಸೋರಿಯಾಸಿಸ್(ಸೋರ),[೪೩] ಮೊದಲಾದ ಕಾಯಿಲೆಗಳಿಗೆ ಹಾಗೂ ನಾನ್-ಹಾಡ್ಕ್ಗಿನ್ನ ಲಿಂಫೋಮ,[೪೪] ಕಲರೆಕ್ಟಲ್ ಕ್ಯಾನ್ಸರ್, ತಲೆ ಮತ್ತು ಕತ್ತು ಕ್ಯಾನ್ಸರ್ ಮತ್ತು ಸ್ತನ ಕ್ಯಾನ್ಸರ್ನಂತಹ ಅನೇಕ ರೀತಿಯ ಕ್ಯಾನ್ಸರ್ಗಳಿಗೆ ಚಿಕಿತ್ಸೆ ನೀಡಲು ಬಳಸಲಾಗುತ್ತದೆ.[೪೫] X-ಸಂಬಂಧಿತ ಅಗ್ಯಾಮಾಗ್ಲಾಬ್ಯುಲಿನೀಮಿಯ ಮತ್ತು ಹೈಪೊಗ್ಯಾಮಗ್ಲಾಬ್ಯುಲಿನೀಮಿಯ ಮೊದಲಾದ ಕೆಲವು ಪ್ರತಿರಕ್ಷಣಾ ನ್ಯೂನ್ಯತೆಗಳು ಪ್ರತಿಕಾಯಗಳ ಭಾಗಶಃ ಅಥವಾ ಸಂಪೂರ್ಣ ಕೊರತೆಗೆ ಕಾರಣವಾಗುತ್ತವೆ.[೪೬] ಈ ಕಾಯಿಲೆಗಳಿಗೆ ಹೆಚ್ಚಾಗಿ ನಿಷ್ಕ್ರಿಯ ಪ್ರತಿರಕ್ಷೆ ಎಂಬ ಪ್ರತಿರಕ್ಷೆಯ ಸರಳ ಪದದ ಮೂಲಕ ಚಿಕಿತ್ಸೆ ನೀಡಲಾಗುತ್ತದೆ. ಸಿದ್ಧ ಪ್ರತಿಕಾಯಗಳನ್ನು ಮಾನವನ ಅಥವಾ ಪ್ರಾಣಿಯ ಸೀರಮ್, ನಿಶ್ಚಲ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಅಥವಾ ಏಕಕ್ಲೋನೀಯ ಪ್ರತಿಕಾಯಗಳ ರೂಪದಲ್ಲಿ ಸೋಂಕಿತ ರೋಗಿಗೆ ವರ್ಗಾಯಿಸುವ ಮೂಲಕ ನಿಷ್ಕ್ರಿಯ ಪ್ರತಿರಕ್ಷೆಯನ್ನು ಸಾಧಿಸಲಾಗುತ್ತದೆ.[೪೭]
ಪ್ರಸವಪೂರ್ವ ಚಿಕಿತ್ಸೆ
[ಬದಲಾಯಿಸಿ]ರೀಸಸ್ D (RhD) ಪ್ರತಿಜನಕ ಎಂದೂ ಕರೆಯುವ ರೀಸಸ್ ಅಂಶವು ಕೆಂಪು ರಕ್ತಕಣದಲ್ಲಿ ಕಂಡುಬರುವ ಒಂದು ಪ್ರತಿಜನಕವಾಗಿದೆ; ರೀಸಸ್-ಪಾಸಿಟಿವ್ (Rh+) ಆಗಿರುವವರು ಈ ಪ್ರತಿಜನಕವನ್ನು ಅವರ ಕೆಂಪು ರಕ್ತಕಣದಲ್ಲಿ ಹೊಂದಿರುತ್ತಾರೆ, ಅದೇ ರೀಸಸ್-ನೆಗೆಟಿವ್ (Rh–) ಆಗಿರುವವರು ಹೊಂದಿರುವುದಿಲ್ಲ. ಸಹಜ ಹೆರಿಗೆ, ಪ್ರಸವದ ಆಘಾತ ಅಥವಾ ಗರ್ಭಾವಸ್ಥೆಯ ಸಮಸ್ಯೆಗಳ ಸಂದರ್ಭದಲ್ಲಿ, ಭ್ರೂಣದ ರಕ್ತವು ತಾಯಿಯ ದೇಹವನ್ನು ಪ್ರವೇಶಿಸಬಹುದು. ತಾಯಿ ಮತ್ತು ಮಗುವಿನಲ್ಲಿ Rh-ಹೊಂದಿಕೆಯಿಲ್ಲದಾಗ, ಅನುಗತ ರಕ್ತ ಮಿಶ್ರಣವು Rh- ತಾಯಿಯು Rh+ ಮಗುವಿನ ರಕ್ತ ಕಣಗಳಲ್ಲಿರುವ Rh ಪ್ರತಿಜನಕಕ್ಕೆ ಸೂಕ್ಷ್ಮಪ್ರತಿಕ್ರಿಯಾಕಾರಿಯಾಗುವಂತೆ ಮಾಡುತ್ತದೆ. ಇದು ಗರ್ಭಾವಸ್ಥೆಯ ಮುಂದಿನ ಅವಧಿಯಲ್ಲಿ ಮತ್ತು ಆನಂತರದ ಗರ್ಭಾವಸ್ಥೆಗಳಲ್ಲಿ ಮಗುವಿಗೆ ಹೀಮೊಲಿಟಿಕ್ ಕಾಯಿಲೆ ಬರುವಂತಹ ಅಪಾಯಕ್ಕೆ ಒಡ್ಡುತ್ತದೆ.[೪೮]
Rho(D) ಪ್ರತಿರಕ್ಷಣಾ ಗ್ಲಾಬ್ಯುಲಿನ್ ಪ್ರತಿಕಾಯಗಳು ಮಾನವನ ರೀಸಸ್ D (RhD) ಪ್ರತಿಜನಕಕ್ಕೆ ನಿರ್ದಿಷ್ಟವಾಗಿರುತ್ತವೆ.[೪೯] ರೀಸಸ್-ನೆಗೆಟಿವ್ ತಾಯಿಯು ರೀಸಸ್-ಪಾಸಿಟಿನ್ ಭ್ರೂಣವನ್ನು ಹೊಂದಿರುವಾಗ ಕಂಡುಬರಬಹುದಾದ ಸೂಕ್ಷ್ಮಗ್ರಾಹೀಕರಣವನ್ನು ತಡೆಗಟ್ಟಲು ಪ್ರಸವಪೂರ್ವ ಚಿಕಿತ್ಸೆ ಕ್ರಮದ ಭಾಗವಾಗಿ RhD-ವಿರೋಧಿ ಪ್ರತಿಕಾಯಗಳನ್ನು ನೀಡಲಾಗುತ್ತದೆ. ಆಘಾತ ಮತ್ತು ಪ್ರಸವದ ಮುಂಚೆ ಮತ್ತು ಅದಾದ ಕೂಡಲೇ RhD-ವಿರೋಧಿ ಪ್ರತಿಕಾಯಗಳನ್ನು ಕೊಟ್ಟು ತಾಯಿಗೆ ಚಿಕಿತ್ಸೆ ನೀಡುವುದರಿಂದ ತಾಯಿಯ ದೇಹದಲ್ಲಿರುವ ಭ್ರೂಣದಿಂದ Rh ಪ್ರತಿಜನಕವು ನಾಶವಾಗುತ್ತದೆ. ಮುಖ್ಯವಾಗಿ ಪ್ರತಿಜನಕವು ತಾಯಿಯ B ಜೀವಕೋಶಗಳನ್ನು, ಜ್ಞಾಪಕ B ಜೀವಕೋಶಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವ ಮೂಲಕ Rh ಪ್ರತಿಜನಕವನ್ನು "ಜ್ಞಾಪಿಸಿಕೊಳ್ಳುವಂತೆ" ಪ್ರೇರೇಪಿಸುವುದಕ್ಕಿಂತ ಮೊದಲು ಇದು ಕಂಡುಬರುತ್ತದೆ. ಆದ್ದರಿಂದ ತಾಯಿಯ ರಸಧಾತುಗಳ ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆಯು Rh-ವಿರೋಧಿ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವುದಿಲ್ಲ.ಅಲ್ಲದೇ ಪ್ರಸ್ತುತ ಅಥವಾ ಮುಂದಿನ ಮಗುವಿನ ರೀಸಸ್ ಪ್ರತಿಜನಕದ ಮೇಲೆ ದಾಳಿ ಮಾಡುವುದಿಲ್ಲ. Rho(D) ಪ್ರತಿರಕ್ಷಣಾ ಗ್ಲಾಬ್ಯುಲಿನ್ ಚಿಕಿತ್ಸೆಯು ಮುಂದೆ Rh ಕಾಯಿಲೆಯನ್ನುಂಟುಮಾಡಬಹುದಾದ ಸೂಕ್ಷ್ಮಗ್ರಾಹೀಕರಣವನ್ನು ತಡೆಯುತ್ತದೆ. ಆದರೆ ಇದು ಮೂಲವಾಗಿರುವ ಕಾಯಿಲೆಯನ್ನು ತಡೆಗಟ್ಟುವುದಿಲ್ಲ ಅಥವಾ ಅದಕ್ಕೆ ಚಿಕಿತ್ಸೆ ನೀಡುವುದಿಲ್ಲ.[೪೯]
ಸಂಶೋಧನಾ ಅಳವಡಿಕೆಗಳು
[ಬದಲಾಯಿಸಿ]
ನಿರ್ದಿಷ್ಟ ಪ್ರತಿಕಾಯಗಳನ್ನು ಪ್ರತಿಜನಕವೊಂದನ್ನು ಸ್ವಲ್ಪ ಪ್ರಮಾಣದ ಪ್ರತಿಕಾಯಕ್ಕಾಗಿ ಇಲಿ, ದೊಡ್ಡ ಇಲಿ ಅಥವಾ ಮೊಲ ಮೊದಲಾದ ಸಸ್ತನಿಗಳಿಗೆ ಅಥವಾ ಹೆಚ್ಚಿನ ಪ್ರಮಾಣದ ಪ್ರತಿಕಾಯಕ್ಕಾಗಿ ಆಡು, ಕುರಿ ಅಥವಾ ಕುದುರೆ ಮೊದಲಾದ ಪ್ರಾಣಿಗಳಿಗೆ ಚುಚ್ಚುವ ಮೂಲಕ ಉತ್ಪತ್ತಿ ಮಾಡಲಾಗುತ್ತದೆ. ಈ ಪ್ರಾಣಿಗಳಿಂದ ಪಡೆದ ರಕ್ತವು ಸೀರಮ್ನಲ್ಲಿ ಪಾಲಿಕ್ಲೋನಲ್ ಪ್ರತಿಕಾಯ ಗಳನ್ನು- ಒಂದೇ ಪ್ರತಿಜನಕಕ್ಕೆ ಬಂಧಿಸಿರುವ ಹಲವು ಪ್ರತಿಕಾಯಗಳು(ಗಳನ್ನು)- ಹೊಂದಿರುತ್ತದೆ, ಇದನ್ನು ನಂತರ ಆಂಟಿಸೀರಮ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಮೊಟ್ಟೆಯ ಹಳದಿ ಲೋಳೆಯಲ್ಲಿ ಪಾಲಿಕ್ಲೋನಲ್ ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುವುದಕ್ಕಾಗಿ ಪ್ರತಿಜನಕಗಳನ್ನು ಕೋಳಿಗಳಿಗೂ ಚುಚ್ಚಲಾಗುತ್ತದೆ.[೫೦] ಪ್ರತಿಜನಕದ ಒಂದು ಎಪಿಟೋಪ್ಗೆ(ನಿರೋಧಕ ಅಂಗಾಂಶ) ನಿರ್ದಿಷ್ಟವಾಗಿರುವ ಪ್ರತಿಕಾಯವನ್ನು ಪಡೆಯಲು, ಪ್ರಾಣಿಯಿಂದ ಪ್ರತಿಕಾಯವನ್ನು ಸ್ರವಿಸುವ ದುಗ್ಧಕೋಶಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸಿ, ಅವನ್ನು ಕ್ಯಾನ್ಸರ್ ಜೀವಕೋಶದೊಂದಿಗೆ ಸಂಯೋಜಿಸುವ ಮೂಲಕ ಶಾಶ್ವತವಾಗಿ ಉಳಿಯುವಂತೆ ಮಾಡಲಾಗುತ್ತದೆ. ಈ ಸಂಯೋಜಿತ ಜೀವಕೋಶಗಳನ್ನು ಹೈಬ್ರಿಡೋಮಗಳೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ, ಅವು ನಿರಂತರವಾಗಿ ಬೆಳೆದು, ಪ್ರತಿಕಾಯಗಳನ್ನು ಸ್ರವಿಸುತ್ತವೆ. ಒಂದೇ ರೀತಿಯ ಪ್ರತಿಕಾಯವನ್ನು ಉತ್ಪತ್ತಿಮಾಡುವ ಜೀವಕೋಶದ ಕ್ಲೋನ್ಗಳನ್ನು ಸೃಷ್ಟಿಸಲು ಏಕ ಹೈಬ್ರಿಡೋಮ ಜೀವಕೋಶಗಳನ್ನು ದುರ್ಬಲಗೊಳಿಸುವ ಕ್ಲೋನಿಂಗ್ ಮೂಲಕ ಪ್ರತ್ಯೇಕಿಸಲಾಗುತ್ತದೆ; ಈ ಪ್ರತಿಕಾಯಗಳನ್ನು ಮೋನೊಕ್ಲೋನಲ್ ಪ್ರತಿಕಾಯ ಗಳೆಂದು ಕರೆಯುತ್ತಾರೆ.[೫೧] ಪಾಲಿಕ್ಲೋನಲ್ ಮತ್ತು ಮೋನೊಕ್ಲೋನಲ್ ಪ್ರತಿಕಾಯಗಳನ್ನು ಹೆಚ್ಚಾಗಿ ಪ್ರೋಟೀನ್ A/G ಅಥವಾ ಪ್ರತಿಜನಕ-ಆಕರ್ಷಣ ಕ್ರೊಮ್ಯಾಟೊಗ್ರಫಿಯನ್ನು ಬಳಸಿಕೊಂಡು ಪರಿಶುದ್ಧಗೊಳಿಸಲಾಗುತ್ತದೆ.[೫೨]
ಸಂಶೋಧನೆಯಲ್ಲಿ, ಶುದ್ಧಗೊಳಿಸಿದ ಪ್ರತಿಕಾಯಗಳನ್ನು ಅನೇಕ ಅನ್ವಯಗಳಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಅವನ್ನು ಹೆಚ್ಚಾಗಿ ಅಂತರ್ಜೀವಕೋಶ ಮತ್ತು ಬಹಿರ್ಜೀವಕೋಶ ಪ್ರೋಟೀನ್ಗಳನ್ನು ಗುರುತಿಸಲು ಮತ್ತು ನೆಲೆಗೊಳಿಸಲು ಉಪಯೋಗಿಸಲಾಗುತ್ತದೆ. ಪ್ರತಿಕಾಯಗಳನ್ನು ಫ್ಲೊ ಸೈಟೊಮೆಟ್ರಿಯಲ್ಲಿ ಜೀವಕೋಶ ಪ್ರಕಾರಗಳನ್ನು ಅವು ಹೊಂದಿರುವ ಪ್ರೋಟೀನ್ಗಳ ಆಧಾರದಲ್ಲಿ ಪ್ರತ್ಯೇಕಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ; ವಿವಿಧ ಪ್ರಕಾರದ ಜೀವಕೋಶಗಳು ಅವುಗಳ ಮೇಲ್ಮೈಯಲ್ಲಿ ವಿಭಿನ್ನ ಅಣುಗಳ ಸಮೂಹದ ವಿವಿಧ ಸಂಯೋಗಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.ಜೊತೆಗೆ ವಿವಿಧ ಅಂತರ್ಜೀವಕೋಶ ಮತ್ತು ಸ್ರವಿಸುವ ಪ್ರೋಟೀನ್ಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡುತ್ತವೆ.[೫೩] ಅವನ್ನು ಇಮ್ಯುನೊಪ್ರೆಸಿಪಿಟೇಶನ್(ಪ್ರತಿರಕ್ಷಣಾ-ಒತ್ತರಿಸುವಿಕೆ)ನಲ್ಲಿ, ಪ್ರೋಟೀನ್ಗಳನ್ನು ಮತ್ತು ಅವುಗಳಿಗೆ ಬಂಧಿಸಿದ ಎಲ್ಲವನ್ನು ಜೀವಕೋಶ ಲೈಸೇಟ್ನಲ್ಲಿ ಇತರ ಅಣುಗಳಿಂದ ಪ್ರತ್ಯೇಕಿಸಲು ಬಳಸಲಾಗುತ್ತದೆ.[೫೪] ಅಲ್ಲದೆ ಅವನ್ನು ವೆಸ್ಟರ್ನ್ ಬ್ಲಾಟ್ ವಿಶ್ಲೇಷಣೆಯಲ್ಲಿ, ಎಲೆಕ್ಟ್ರೊಫೋರೆಸಿಸ್(ವಿದ್ಯುತ್ಸರಣ)ನಿಂದ ಪ್ರತ್ಯೇಕಿಸಲ್ಪಟ್ಟ ಪ್ರೋಟೀನ್ಗಳನ್ನು ಗುರುತಿಸಲು[೫೫] ಹಾಗೂ ಇಮ್ಯುನೊಹಿಸ್ಟೊಕೆಮೆಸ್ಟ್ರಿ ಅಥವಾ ಇಮ್ಯುನೊಫ್ಲೋರೆಸೆನ್ಸ್ನಲ್ಲಿ, ಅಂಗಾಂಶದಲ್ಲಿ ಪ್ರೋಟೀನ್ನ ಅಭಿವ್ಯಕ್ತಿಯನ್ನು ಪರಿಶೀಲಿಸಲು ಅಥವಾ ಮೈಕ್ರೊಸ್ಕೋಪ್ನ ನೆರವಿನಿಂದ ಜೀವಕೋಶಗಳೊಳಗೆ ಪ್ರೋಟೀನ್ಗಳನ್ನು ಸ್ಥಾಪಿಸಲು ಉಪಯೋಗಿಸಲಾಗುತ್ತದೆ.[೫೩][೫೬] ELISA ಮತ್ತು ELISPOT ವಿಧಾನಗಳನ್ನು ಬಳಸಿಕೊಂಡು ಪ್ರತಿಕಾಯಗಳಿಂದ ಪ್ರೋಟೀನ್ಗಳನ್ನೂ ಸಹ ಪತ್ತೆಹಚ್ಚಿ, ಅವುಗಳ ಪರಿಮಾಣವನ್ನೂ ನಿರ್ಧರಿಸಬಹುದು.[೫೭][೫೮]
ರಚನೆಯ ಕಲ್ಪನೆ
[ಬದಲಾಯಿಸಿ]ಆರೋಗ್ಯ ರಕ್ಷಣೆ ಮತ್ತು ಜೈವಿಕ-ತಂತ್ರಜ್ಞಾನ ಉದ್ಯಮದಲ್ಲಿ ಪ್ರತಿಕಾಯಗಳ ಪ್ರಾಮುಖ್ಯತೆಯು ಅವುಗಳ ರಚನೆಯನ್ನು ಹೆಚ್ಚಿನ ಪೃಥಕ್ಕರಣದಲ್ಲಿ ತಿಳಿದುಕೊಳ್ಳುವಂತೆ ಮಾಡುತ್ತದೆ. ಈ ಮಾಹಿತಿಯನ್ನು ನಿರ್ದಿಷ್ಟ ಪ್ರತಿಕಾಯದ ಪ್ರೋಟೀನ್ ಇಂಜಿನಿಯರಿಂಗ್, ಪ್ರತಿಜನಕ ಬಂಧಿಸುವ ಆಕರ್ಷಣ ಬಲದ ಪರಿವರ್ತನೆ ಮತ್ತು ಎಪಿಟೋಪ್ನ ಗುರುತಿಸುವಿಕೆ ಮೊದಲಾದವುಗಳಿಗಾಗಿ ಬಳಸಲಾಗುತ್ತದೆ. (ಕ್ಷ) X-ಕಿರಣ ಸ್ಫಟಿಕಶಾಸ್ತ್ರವು ಪ್ರತಿಕಾಯದ ರಚನೆಗಳನ್ನು ಕಂಡುಹಿಡಿಯಲು ಸಾಮಾನ್ಯವಾಗಿ ಬಳಸುವ ಒಂದು ವಿಧಾನವಾಗಿದೆ. ಆದರೆ ಪ್ರತಿಕಾಯವನ್ನು ಸ್ಫಟಕೀಕರಿಸುವುದು ಹೆಚ್ಚು ಪ್ರಯಾಸದಾಯಕವಾಗಿರುತ್ತದೆ;ಅದಕ್ಕೆ ಅಧಿಕ ಸಮಯವೂ ಬೇಕಾಗುತ್ತದೆ. ಕಂಪ್ಯೂಟರಿನ ಸಾಧನೆಗಳು ಸ್ಫಟಿಕಶಾಸ್ತ್ರಕ್ಕೆ ಒಂದು ಕಡಿಮೆ ಖರ್ಚಿನ, ವೇಗದ ಪರ್ಯಾಯವನ್ನು ಒದಗಿಸುತ್ತವೆ. ಆದರೆ ಅವು ಪ್ರಾಯೋಗಿಕ ರಚನೆಗಳನ್ನು ನೀಡದಿರುವುದರಿಂದ ಅವುಗಳ ಫಲಿತಾಂಶಗಳು ಹೆಚ್ಚು ಅನಿಶ್ಚಿತವಾಗಿರುತ್ತವೆ. ವೆಬ್ ಆಂಟಿಬಾಡಿ ಮಾಡೆಲಿಂಗ್ (WAM)[೫೯] ಮತ್ತು ಪ್ರೆಡಿಕ್ಷನ್ ಆಫ್ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಸ್ಟ್ರಕ್ಚರ್ (PIGS)[೬೦] ಮೊದಲಾದ ಆನ್ಲೈನ್ ವೆಹ್ ಸರ್ವರ್ಗಳು ಪ್ರತಿಕಾಯದ ವ್ಯತ್ಯಾಸಗೊಳ್ಳುವ ಭಾಗಗಳ ಕಂಪ್ಯೂಟರಿನ ಮಾದರಿಯನ್ನು ಒದಗಿಸುತ್ತವೆ. ರೊಸೆಟ್ಟ ಆಂಟಿಬಾಡಿಯು ಪ್ರತಿಕಾಯ FV ಭಾಗದ ರಚನೆಯನ್ನು ಕಲ್ಪಿಸುವ ಒಂದು ಸರ್ವರ್ ಆಗಿದೆ. ಅದು CDR ಲೂಪ್ಗಳನ್ನು ಕಡಿಮೆಗೊಳಿಸುವ ಹಾಗೂ ಸರಳ ಮತ್ತು ದೀರ್ಘ ಸರಪಣಿಗಳ ಸ್ಥಾನವನ್ನು ಅತ್ಯುತ್ತಮವಾಗಿಸುವ ಅತ್ಯಾಧುನಿಕ ವಿಧಾನಗಳನ್ನು ಒಳಗೊಂಡಿದೆ. ಅಲ್ಲದೆ ಇದು ಪ್ರತಿಕಾಯಗಳು ಅವುಗಳ ಅನನ್ಯ ಪ್ರತಿಜನಕದೊಂದಿಗೆ ಬಂಧಿಸುವ ಬಗೆಗಿನ ಉತ್ತಮ ಕಲ್ಪನೆಯನ್ನು ನೀಡುವ ಸಮಾನರೂಪತೆ(ಹೋಮೋಲಜಿ) ಮಾದರಿಗಳನ್ನೂ ಒಳಗೊಂಡಿದೆ.[೬೧]
ಇತಿಹಾಸ
[ಬದಲಾಯಿಸಿ]"ಪ್ರತಿಕಾಯ" ಪದದ ಮೊದಲ ಬಳಕೆಯು ಪಾಲ್ ಎಹ್ರ್ಲಿಚ್ನ ಗ್ರಂಥಭಾಗದಲ್ಲಿ ಕಂಡುಬಂದಿದೆ. ಆಂಟಿಕೋರ್ಪರ್ (ಆಂಟಿಬಾಡಿ(ಪ್ರತಿಕಾಯ) ಯ ಜರ್ಮನ್ ಪದ) ಪದವು 1891ರ ಅಕ್ಟೋಬರ್ನಲ್ಲಿ ಪ್ರಕಟವಾದ ಅವನ ಲೇಖನ "ಎಕ್ಸ್ಪರಿಮೆಂಟಲ್ ಸ್ಟಡೀಸ್ ಆನ್ ಇಮ್ಯೂನಿಟಿ"ಯ ಕೊನೆಯಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ, ಅದು ಹೀಗಿದೆ - "ಎರಡು ಅಂಶಗಳು ಎರಡು ಬೇರೆಬೇರೆ ಆಂಟಿಕೋರ್ಪರ್ಅನ್ನು ನೀಡಿದರೆ, ಅವು ಬೇರೆಬೇರೆಯಾಗಿರಬೇಕಾಗಿರುತ್ತದೆ".[೬೨]. ಆದರೂ ಆ ಪದವನ್ನು ತಕ್ಷಣವೇ ಪಡೆಯಲಿಲ್ಲ. ಆಂಟಿಬಾಡಿ(ಪ್ರತಿಕಾಯ)ಗೆ ಕೆಲವು ಇತರ ಪದಗಳನ್ನು ಸೂಚಿಸಲಾಯಿತು; ಅವುಗಳೆಂದರೆ ಇಮ್ಯುನೊಕೋರ್ಪರ್ , ಆಂಬೊಸೆಪ್ಟರ್ , ಜ್ವಿಸ್ಚೆಂಕೋರ್ಪರ್ , ಸಬ್ಸ್ಟ್ಯಾನ್ಸ್ ಸೆನ್ಸಿಬಿಲಿಸ್ಯಾಟ್ರೈಸ್ , ಕೋಪುಲ , ಡೆಮ್ಸನ್ , ಫಿಲೊಸೈಟೇಸ್ , ಫಿಕ್ಸೇಚರ್ ಮತ್ತು ಇಮ್ಯುನಿಸಿನ್ .[೬೨] ಆಂಟಿಬಾಡಿ(ಪ್ರತಿಕಾಯ) ಪದವು ಆಂಟಿಟಾಕ್ಸಿನ್(ವಿಷನಿರೋಧಕ) ಪದಕ್ಕೆ ಹಾಗೂ ಅದೇ ರೀತಿ ಇಮ್ಯುನೊಕೋರ್ಪರ್ ಗೂ ಶಾಬ್ದಿಕ ಹೋಲಿಕೆಯನ್ನು ಹೊಂದಿದೆ.[೬೨]

ಪ್ರತಿಕಾಯಗಳ ಅಧ್ಯಯನವು 1890ರಲ್ಲಿ ಎಮಿಲ್ ವನ್ ಬೆಹ್ರಿಂಗ್ ಮತ್ತು ಶಿಬಾಸಬುರೊ ಕಿಟಸ್ಯಾಟೊ ಡಿಫ್ಟೀರಿಯ ಮತ್ತು ಧನುರ್ವಾಯು ಜೀವಾಣು ವಿಷದದ ವಿರುದ್ಧ ಪ್ರತಿಕಾಯದ ಕ್ರಿಯೆಯನ್ನು ವಿವರಿಸಿದಾಗ ಆರಂಭವಾಯಿತು. ಬೆಹ್ರಿಂಗ್ ಮತ್ತು ಕಿಟಸ್ಯಾಟೊ ರಸಧಾತುಗಳ ಪ್ರತಿರಕ್ಷೆಯ ಅಧ್ಯಯನವನ್ನು ಪ್ರಸ್ತಾಪಿಸುವ ಮೂಲಕ, ಸೀರಮ್ನಲ್ಲಿರುವ ಒಂದು ಮಧ್ಯವರ್ತಿಯು ಹೊರಗಿನ ಪ್ರತಿಜನಕದೊಂದಿಗೆ ಕ್ರಿಯೆ ನಡೆಸಬಹುದು ಎಂದು ಸೂಚಿಸಿದರು.[೬೬][೬೭] ಅವರ ಕಲ್ಪನೆಯು 1897ರಲ್ಲಿ ಪಾಲ್ ಎಹ್ರ್ಲಿಂಚ್ಗೆ ಪ್ರತಿಕಾಯ ಮತ್ತು ಪ್ರತಿಜನಕದ ಪರಸ್ಪರ ಕ್ರಿಯೆಯ ಸೈಡ್ ಚೈನ್(ಬದಿಯ ಸರಪಣಿ) ಸಿದ್ಧಾಂತವನ್ನು ಪ್ರಸ್ತಾಪಿಸುವಂತೆ ಪ್ರೇರೇಪಿಸಿತು. ಅದರಲ್ಲಿ ಅವನು ಜೀವಕೋಶಗಳ ಮೇಲ್ಮೆಯಲ್ಲಿರುವ ಗ್ರಾಹಕಗಳು (“ಸೈಡ್ ಚೈನ್” ಎಂದು ವಿವರಿಸಲಾಗಿದೆ) ನಿರ್ದಿಷ್ಟವಾಗಿ ಜೀವಾಣು ವಿಷಗಳೊಂದಿಗೆ "ಬೀಗ ಮತ್ತು ಕೀ" ಪರಸ್ಪರ ಕ್ರಿಯೆಯಲ್ಲಿ ಬಂಧಿಸಬಲ್ಲವು ಹಾಗೂ ಈ ಬಂಧಿಸುವ ಕ್ರಿಯೆಯು ಪ್ರತಿಕಾಯಗಳ ಉತ್ಪತ್ತಿಯನ್ನು ಉತ್ತೇಜಿಸುತ್ತದೆ ಎಂಬ ಆಧಾರಕಲ್ಪನೆಯನ್ನು ರೂಪಿಸಿದ್ದಾನೆ.[೬೮] ಪ್ರತಿಕಾಯಗಳು ರಕ್ತದಲ್ಲಿ ಸ್ವಂತತ್ರವಾಗಿರುತ್ತವೆ ಎಂದು ಇತರ ಸಂಶೋಧಕರು ನಂಬಿದ್ದರು. 1904ರಲ್ಲಿ ಆಲ್ಮ್ರಾತ್ ವ್ರೈಟ್, ಕರಗಬಲ್ಲ ಪ್ರತಿಕಾಯಗಳು ಬ್ಯಾಕ್ಟೀರಿಯಾಗಳಿನ್ನು ಫ್ಯಾಗೊಸೈಟಾಸಿಸ್ಗೆ ಒಳಪಡಿಸಿ, ಸಾಯಿಸುವುದಕ್ಕಾಗಿ ಅವುಗಳನ್ನು ಆವರಿಸಿರುತ್ತವೆ ಎಂದು ಸೂಚಿಸಿದನು; ಈ ಕ್ರಿಯೆಯನ್ನು ಅವನು ಆಪ್ಸೋನಿನೈಸೇಶನ್ ಎಂದು ಹೆಸರಿಸಿದನು.[೬೯]
1920ರಲ್ಲಿ ಮೈಕೆಲ್ ಹೈಡೆಲ್ಬರ್ಗರ್ ಮತ್ತು ಆಸ್ವಾಲ್ಡ್ ಆವೆರಿ, ಪ್ರತಿಜನಕಗಳನ್ನು ಪ್ರತಿಕಾಯಗಳಿಂದ ಅವಕ್ಷೇಪಿಸಬಹುದು ಎಂದೂ ಸೂಚಿಸಿದರು.ಅಲ್ಲದೇ ಪ್ರತಿಕಾಯಗಳು ಪ್ರೋಟೀನ್ನಿಂದ ರಚಿತವಾಗಿವೆಯೆಂದು ತೋರಿಸಿಕೊಟ್ಟರು.[೭೦] ಪ್ರತಿಜನಕ-ಪ್ರತಿಕಾಯ ಬಂಧನದ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳ ಜೈವಿಕ-ರಾಸಾಯನಿಕ ಗುಣಲಕ್ಷಣಗಳನ್ನು 1930ರ ಉತ್ತರಾರ್ಧದಲ್ಲಿ ಜಾನ್ ಮರಾಕ್ ಹೆಚ್ಚು ವಿವರಾತ್ಮಕವಾಗಿ ಪರಿಶೀಲಿಸಿದನು.[೭೧] ಇನ್ನಷ್ಟು ಹೆಚ್ಚಿನ ಬೆಳವಣಿಗೆಯು 1940ರಲ್ಲಿ ಲಿನಸ್ ಪಾಲಿಂಗ್, ಎಹ್ರ್ಲಿಚ್ ಪ್ರಸ್ತಾಪಿಸಿದ ಬೀಗ-ಮತ್ತು-ಕೀ ಸಿದ್ಧಾಂತವನ್ನು ದೃಢಪಡಿಸಿದಾಗ ಕಂಡುಬಂದಿತು. ಅವನು ಪ್ರತಿಕಾಯಗಳು ಮತ್ತು ಪ್ರತಿಜನಕಗಳ ನಡುವಿನ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳು ಅವುಗಳ ರಾಸಾಯನಿಕ ಸಂಯೋಜನೆಗಿಂತ ಹೆಚ್ಚು ಆಕಾರವನ್ನು ಅವಲಂಬಿಸಿರುತ್ತವೆ ಎಂದು ತೋರಿಸಿಕೊಟ್ಟನು.[೭೨] 1948ರಲ್ಲಿ ಆಸ್ಟ್ರಿಡ್ ಫ್ಯಾಗ್ರಿಯಸ್, ಪ್ಲಾಸ್ಮಾ ಜೀವಕೋಶಗಳ ರೂಪದಲ್ಲಿ B ಜೀವಕೋಶಗಳು ಪ್ರತಿಕಾಯಗಳನ್ನು ಉತ್ಪತ್ತಿ ಮಾಡಬಲ್ಲವೆಂದು ಕಂಡುಹಿಡಿದನು.[೭೩]
ಇನ್ನಷ್ಟು ಸಂಶೋಧನೆಗಳು ಪ್ರತಿಕಾಯ ಪ್ರೋಟೀನ್ಗಳ ರಚನೆಗಳನ್ನು ನಿರೂಪಿಸುವ ಮೇಲೆ ಹೆಚ್ಚು ಕೇಂದ್ರೀಕೃತವಾದವು. ಈ ರಚನಾತ್ಮಕ ಅಧ್ಯಯನಗಳ ಒಂದು ಪ್ರಮುಖ ಸುಧಾರಣೆಯು 1960ರ ಆರಂಭದಲ್ಲಿ ಗೆರಾಲ್ಡ್ ಎಡೆಲ್ಮ್ಯಾನ್ ಮತ್ತು ಜೋಸೆಫ್ ಗ್ಯಾಲಿ ಪ್ರತಿಕಾಯ ಸರಳ ಸರಪಣಿಯನ್ನು ಆವಿಷ್ಕರಿಸಿದಾಗ ಕಂಡುಬಂದಿತು.[೭೪] ಅವರು ಈ ಪ್ರೋಟೀನ್ ಮತ್ತು 1845ರಲ್ಲಿ ಹೆನ್ರಿ ಬೆನ್ಸ್ ಜೋನ್ಸ್ ವಿವರಿಸಿದ ಬೆನ್ಸ್-ಜೋನ್ಸ್ ಪ್ರೋಟೀನ್ ಒಂದೇ ಆಗಿದೆಯೆಂದು ಸ್ಪಷ್ಟಪಡಿಸಿದರು.[೭೫] ಎಡೆಲ್ಮ್ಯಾನ್ ಪ್ರತಿಕಾಯಗಳು ಡೈಸಲ್ಫೈಡ್ ಬಂಧ-ಸಂಬಂಧಿತ ದೀರ್ಘ ಮತ್ತು ಸರಳ ಸರಪಣಿಗಳಿಂದ ರಚಿತವಾಗಿವೆಯೆಂದು ತೋರಿಸಲು ಅನ್ವೇಷಣೆ ನಡೆಸಿದನು. ಅದೇ ಸಂದರ್ಭದಲ್ಲಿ, IgG ಯ ಪ್ರತಿಕಾಯ-ಬಂಧಿಸುವ (Fab) ಮತ್ತು ಪ್ರತಿಕಾಯ ಟೈಲ್ (Fc) ಭಾಗಗಳನ್ನು ರಾಡ್ನಿ ಪೋರ್ಟರ್ ಕಂಡುಹಿಡಿದನು.[೭೬] ಈ ವಿಜ್ಞಾನಿಗಳು ಒಟ್ಟಾಗಿ IgG ಯ ರಚನೆ ಮತ್ತು ಸಂಪೂರ್ಣ ಅಮೈನೊ ಆಮ್ಲ ಸರಣಿಯನ್ನು ನಿರೂಪಿಸಿದರು. ಅದಕ್ಕಾಗಿ ಅವರು ಜಂಟಿಯಾಗಿ 1972ರ ಶರೀರವಿಜ್ಞಾನ ಅಥವಾ ಔಷಧ ವೈದ್ಯಶಾಸ್ತ್ರದಲ್ಲಿ ನೋಬೆಲ್ ಪ್ರಶಸ್ತಿಯನ್ನು ಪಡೆದರು.[೭೬] ಹೆಚ್ಚಿನ ಈ ಅಧ್ಯಯನಗಳು IgM ಮತ್ತು IgG ಅನ್ನು ಕೇಂದ್ರೀಕರಿಸಿದ್ದವು. ಇತರ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಐಸೊಟೈಪ್ಗಳನ್ನು 1960ರಲ್ಲಿ ಕಂಡುಹಿಡಿಯಲಾಯಿತು: ಥೋಮಸ್ ಟೋಮಸಿ ಸ್ರಾವಕ ಪ್ರತಿಕಾಯವನ್ನು (IgA)[೭೭] ಹಾಗೂ ಡೇವಿಡ್ ರೋವೆ[disambiguation needed] ಮತ್ತು ಜಾನ್ ಫ್ಯಾಹೆ[disambiguation needed] IgD ಅನ್ನು ಆವಿಷ್ಕರಿಸಿದರು.[೭೮] ಅಲರ್ಜಿಯ ಕ್ರಿಯೆಗಳಲ್ಲಿ ಭಾಗವಹಿಸುವ ಪ್ರತಿಕಾಯಗಳ ಒಂದು ವರ್ಗ IgEಅನ್ನು ಕಿಕಿಶಿಗ್ ಇಶಿಜಾಕ ಮತ್ತು ಟೆರುಕಿ ಇಶಿಜಾಕ ಕಂಡುಹಿಡಿದರು.[೭೯] ಈ ಪ್ರತಿಕಾಯ ಪ್ರೋಟೀನ್ಗಳ ವ್ಯಾಪಕ ವೈವಿಧ್ಯತೆಯ ಮೂಲವನ್ನು ಗುರುತಿಸುವ ಜೀನ್ಗಳ ಅಧ್ಯಯನವು, ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಜೀನ್ಗಳ ಶಾರೀರಿಕ ಪುನಃಸಂಯೋಜನೆಯನ್ನು 1976ರಲ್ಲಿ ಸುಸುಮು ಟೊನೆಗಾವ ಆವಿಷ್ಕರಿಸಿದಾಗ ಕಂಡುಬಂದಿತು.[೮೦]
ಇವನ್ನೂ ಗಮನಿಸಿ
[ಬದಲಾಯಿಸಿ]- ಪ್ರತಿಕಾಯ ಬಾಹ್ಯಹೋಲಿಕೆ
- ಮೈಟೊಕಾಂಡ್ರಿಯಲ್-ವಿರೋಧಿ ಪ್ರತಿಕಾಯಗಳು
- ನ್ಯೂಕ್ಲಿಯರ್-ವಿರೋಧಿ ಪ್ರತಿಕಾಯಗಳು
- ಕೊಲಸ್ಟ್ರಮ್
- ELISA
- ರಸಧಾತುಗಳ ಪ್ರತಿರಕ್ಷೆ
- ಇಮ್ಯೂನಾಲಜಿ (ರೋಗರಕ್ಷಾ ಶಾಸ್ತ್ರ)
- ಇಮ್ಯುನೊಸಪ್ರೆಸ್ಸಿವ್ ಔಷಧ
- ಇಂಟ್ರಾವೀನಸ್ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ (IVIg)
- ಮ್ಯಾಗ್ನೆಟಿಕ್ ಇಮ್ಯೂನಸೆ
- ಮೋನೊಕ್ಲೋನಲ್ ಪ್ರತಿಕಾಯ
- ತಟಸ್ಥಗೊಳಿಸುವ ಪ್ರತಿಕಾಯ
- ಎರಡನೆಯ ಪ್ರತಿಕಾಯಗಳು
- ಏಕ ಡೊಮೇನ್ ಪ್ರತಿಕಾಯ
ಆಕರಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ Litman GW, Rast JP, Shamblott MJ (1993). "Phylogenetic diversification of immunoglobulin genes and the antibody repertoire". Mol. Biol. Evol. 10 (1): 60–72. PMID 8450761.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ ೨.೦ ೨.೧ ೨.೨ ೨.೩ ಎಲಿಯೊನೊರ ಮಾರ್ಕೆಟ್, F. ನಿನ ಪ್ಯಾಪವಾಸಿಲಿಯೊ (2003) V(D)J ರಿಕಾಂಬಿನೇಶನ್ ಆಂಡ್ ದಿ ಎವಲ್ಯೂಶನ್ ಆಫ್ ದಿ ಅಡಾಪ್ಟಿವ್ ಇಮ್ಯೂನ್ ಸಿಸ್ಟಮ್ PLoS ಬಯಾಲಜಿ1(1): e16.
- ↑ ೩.೦ ೩.೧ ೩.೨ ೩.೩ ೩.೪ ೩.೫ ೩.೬ ೩.೭ ೩.೮ Janeway CA, Jr; et al. (2001). Immunobiology (5th ed.). Garland Publishing. ISBN 0-8153-3642-X.
{{cite book}}: Explicit use of et al. in:|author=(help) - ↑ ೪.೦ ೪.೧ ೪.೨ Rhoades RA, Pflanzer RG (2002). Human Physiology (4th ed.). Thomson Learning. ISBN 0-534-42174-1.
- ↑ ೫.೦ ೫.೧ Diaz M, Casali P (2002). "Somatic immunoglobulin hypermutation". Curr Opin Immunol. 14 (2): 235–40. doi:10.1016/S0952-7915(02)00327-8. PMID 11869898.
- ↑ ೬.೦ ೬.೧ ೬.೨ ೬.೩ ೬.೪ ೬.೫ Pier GB, Lyczak JB, Wetzler LM (2004). Immunology, Infection, and Immunity. ASM Press. ISBN 1-55581-246-5.
{{cite book}}: CS1 maint: multiple names: authors list (link) - ↑ Parker D (1993). "T cell-dependent B cell activation". Annu. Rev. Immunol. 11: 331–60. doi:10.1146/annurev.iy.11.040193.001555. PMID 8476565.
- ↑ ೮.೦ ೮.೧ ೮.೨ ೮.೩ Wintrobe, Maxwell Myer (2004). Wintrobe's clinical hematology. John G. Greer, John Foerster, John N Lukens, George M Rodgers, Frixos Paraskevas (11 ed.). Hagerstown, MD: Lippincott Williams & Wilkins. pp. 453–456. ISBN 0-7817-3650-1.
- ↑ Tolar P, Sohn HW, Pierce SK (2008). "Viewing the antigen-induced initiation of B-cell activation in living cells". Immunol. Rev. 221: 64–76. doi:10.1111/j.1600-065X.2008.00583.x. PMID 18275475.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Underdown B, Schiff J (1986). "Immunoglobulin A: strategic defense initiative at the mucosal surface". Annu Rev Immunol. 4: 389–417. doi:10.1146/annurev.iy.04.040186.002133. PMID 3518747.
- ↑ ೧೧.೦ ೧೧.೧ Geisberger R, Lamers M, Achatz G (2006). "The riddle of the dual expression of IgM and IgD". Immunology. 118 (4): 429–37. doi:10.1111/j.1365-2567.2006.02386.x. PMC 1782314. PMID 16895553.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Chen K, Xu W, Wilson M, He B, Miller NW, Bengtén E, Edholm ES, Santini PA, Rath P, Chiu A, Cattalini M, Litzman J, B Bussel J, Huang B, Meini A, Riesbeck K, Cunningham-Rundles C, Plebani A, Cerutti A (2009). "Immunoglobulin D enhances immune surveillance by activating antimicrobial, proinflammatory and B cell-stimulating programs in basophils". Nature Immunology. 10 (8): 889–98. doi:10.1038/ni.1748. PMC 2785232. PMID 19561614.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ ೧೩.೦ ೧೩.೧ ೧೩.೨ ೧೩.೩ Woof J, Burton D (2004). "Human antibody-Fc receptor interactions illuminated by crystal structures". Nat Rev Immunol. 4 (2): 89–99. doi:10.1038/nri1266. PMID 15040582.
- ↑ Goding J (1978). "Allotypes of IgM and IgD receptors in the mouse: a probe for lymphocyte differentiation". Contemp Top Immunobiol. 8: 203–43. PMID 357078.
- ↑ Mattu T, Pleass R, Willis A, Kilian M, Wormald M, Lellouch A, Rudd P, Woof J, Dwek R (1998). "The glycosylation and structure of human serum IgA1, Fab, and Fc regions and the role of N-glycosylation on Fc alpha receptor interactions". J Biol Chem. 273 (4): 2260–72. doi:10.1074/jbc.273.4.2260. PMID 9442070.
{{cite journal}}: CS1 maint: multiple names: authors list (link) CS1 maint: unflagged free DOI (link) - ↑ Roux K (1999). "Immunoglobulin structure and function as revealed by electron microscopy". Int Arch Allergy Immunol. 120 (2): 85–99. doi:10.1159/000024226. PMID 10545762.
- ↑ Barclay A (2003). "Membrane proteins with immunoglobulin-like domains--a master superfamily of interaction molecules". Semin Immunol. 15 (4): 215–23. doi:10.1016/S1044-5323(03)00047-2. PMID 14690046.
- ↑ Putnam FW, Liu YS, Low TL (1979). "Primary structure of a human IgA1 immunoglobulin. IV. Streptococcal IgA1 protease, digestion, Fab and Fc fragments, and the complete amino acid sequence of the alpha 1 heavy chain". J Biol Chem. 254 (8): 2865–74. PMID 107164.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Huber R (1980). "Spatial structure of immunoglobulin molecules". Klin Wochenschr. 58 (22): 1217–31. doi:10.1007/BF01478928. PMID 6780722.
- ↑ Borghesi L, Milcarek C (2006). "From B cell to plasma cell: regulation of V(D)J recombination and antibody secretion". Immunol Res. 36 (1–3): 27–32. doi:10.1385/IR:36:1:27. PMID 17337763.
- ↑ ೨೧.೦ ೨೧.೧ Ravetch J, Bolland S (2001). "IgG Fc receptors". Annu Rev Immunol. 19: 275–90. doi:10.1146/annurev.immunol.19.1.275. PMID 11244038.
- ↑ Rus H, Cudrici C, Niculescu F (2005). "The role of the complement system in innate immunity". Immunol Res. 33 (2): 103–12. doi:10.1385/IR:33:2:103. PMID 16234578.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Racaniello, Vincent (2009-10-06). "Natural antibody protects against viral infection". Virology Blog. Retrieved 2010-01-22.
- ↑ Milland J, Sandrin MS (2006). "ABO blood group and related antigens, natural antibodies and transplantation". Tissue Antigens. 68 (6): 459–66. doi:10.1111/j.1399-0039.2006.00721.x. PMID 17176435.
{{cite journal}}: Unknown parameter|month=ignored (help) - ↑ Mian I, Bradwell A, Olson A (1991). "Structure, function and properties of antibody binding sites". J Mol Biol. 217 (1): 133–51. doi:10.1016/0022-2836(91)90617-F. PMID 1988675.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Fanning LJ, Connor AM, Wu GE (1996). "Development of the immunoglobulin repertoire". Clin. Immunol. Immunopathol. 79 (1): 1–14. doi:10.1006/clin.1996.0044. PMID 8612345.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ ೨೭.೦ ೨೭.೧ Nemazee D (2006). "Receptor editing in lymphocyte development and central tolerance". Nat Rev Immunol. 6 (10): 728–40. doi:10.1038/nri1939. PMID 16998507.
- ↑ ಪೀಟರ್ ಪರ್ಹ್ಯಾಮ್. "ದಿ ಇಮ್ಯೂನ್ ಸಿಸ್ಟಮ್. 2ನೇ ಆವೃತ್ತಿ. ಗಾರ್ಲ್ಯಾಂಡ್ ಸೈನ್ಸ್: ನ್ಯೂಯಾರ್ಕ್, 2005. ಪುಟ 47-62
- ↑ Bergman Y, Cedar H (2004). "A stepwise epigenetic process controls immunoglobulin allelic exclusion". Nat Rev Immunol. 4 (10): 753–61. doi:10.1038/nri1458. PMID 15459667.
- ↑ Honjo T, Habu S (1985). "Origin of immune diversity: genetic variation and selection". Annu Rev Biochem. 54: 803–30. doi:10.1146/annurev.bi.54.070185.004103. PMID 3927822.
- ↑ ೩೧.೦ ೩೧.೧ Or-Guil M, Wittenbrink N, Weiser AA, Schuchhardt J (2007). "Recirculation of germinal center B cells: a multilevel selection strategy for antibody maturation". Immunol. Rev. 216: 130–41. doi:10.1111/j.1600-065X.2007.00507.x. PMID 17367339.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Neuberger M, Ehrenstein M, Rada C, Sale J, Batista F, Williams G, Milstein C (2000). "Memory in the B-cell compartment: antibody affinity maturation". Philos Trans R Soc Lond B Biol Sci. 355 (1395): 357–60. doi:10.1098/rstb.2000.0573. PMC 1692737. PMID 10794054.
{{cite journal}}: Unknown parameter|month=ignored (help)CS1 maint: multiple names: authors list (link) - ↑ Stavnezer J, Amemiya CT (2004). "Evolution of isotype switching". Semin. Immunol. 16 (4): 257–75. doi:10.1016/j.smim.2004.08.005. PMID 15522624.
- ↑ Durandy A (2003). "Activation-induced cytidine deaminase: a dual role in class-switch recombination and somatic hypermutation". Eur. J. Immunol. 33 (8): 2069–73. doi:10.1002/eji.200324133. PMID 12884279.
- ↑ Casali P, Zan H (2004). "Class switching and Myc translocation: how does DNA break?". Nat. Immunol. 5 (11): 1101–3. doi:10.1038/ni1104-1101. PMID 15496946.
- ↑ Lieber MR, Yu K, Raghavan SC (2006). "Roles of nonhomologous DNA end joining, V(D)J recombination, and class switch recombination in chromosomal translocations". DNA Repair (Amst.). 5 (9–10): 1234–45. doi:10.1016/j.dnarep.2006.05.013. PMID 16793349.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ "Animated depictions of how antibodies are used in [[ELISA]] assays". Cellular Technology Ltd.—Europe. Archived from the original on 2007-05-09. Retrieved 2007-05-08.
{{cite web}}: URL–wikilink conflict (help) - ↑ "Animated depictions of how antibodies are used in [[ELISPOT]] assays". Cellular Technology Ltd.—Europe. Archived from the original on 2007-05-01. Retrieved 2007-05-08.
{{cite web}}: URL–wikilink conflict (help) - ↑ Stern P (2006). "Current possibilities of turbidimetry and nephelometry" (PDF). Klin Biochem Metab. 14 (3): 146–151. Archived from the original (PDF) on 2008-02-27.
- ↑ ೪೦.೦ ೪೦.೧ Dean, Laura (2005). "Chapter 4: Hemolytic disease of the newborn". Blood Groups and Red Cell Antigens. NCBI Bethesda (MD): National Library of Medicine (US),.
{{cite book}}: Unknown parameter|chapterurl=ignored (help)CS1 maint: extra punctuation (link) - ↑ Feldmann M, Maini R (2001). "Anti-TNF alpha therapy of rheumatoid arthritis: what have we learned?". Annu Rev Immunol. 19: 163–96. doi:10.1146/annurev.immunol.19.1.163. PMID 11244034.
- ↑ Doggrell S (2003). "Is natalizumab a breakthrough in the treatment of multiple sclerosis?". Expert Opin Pharmacother. 4 (6): 999–1001. doi:10.1517/14656566.4.6.999. PMID 12783595.
- ↑ Krueger G, Langley R, Leonardi C, Yeilding N, Guzzo C, Wang Y, Dooley L, Lebwohl M (2007). "A human interleukin-12/23 monoclonal antibody for the treatment of psoriasis". N Engl J Med. 356 (6): 580–92. doi:10.1056/NEJMoa062382. PMID 17287478.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Plosker G, Figgitt D (2003). "Rituximab: a review of its use in non-Hodgkin's lymphoma and chronic lymphocytic leukaemia". Drugs. 63 (8): 803–43. doi:10.2165/00003495-200363080-00005. PMID 12662126.
- ↑ Vogel C, Cobleigh M, Tripathy D, Gutheil J, Harris L, Fehrenbacher L, Slamon D, Murphy M, Novotny W, Burchmore M, Shak S, Stewart S (2001). "First-line Herceptin monotherapy in metastatic breast cancer". Oncology. 61 Suppl 2: 37–42. doi:10.1159/000055400. PMID 11694786.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ LeBien TW (1 July 2000). "Fates of human B-cell precursors". Blood. 96 (1): 9–23. PMID 10891425.
- ↑ Ghaffer A (2006-03-26). "Immunization". Immunology - Chapter 14. University of South Carolina School of Medicine. Retrieved 2007-06-06.
- ↑ Urbaniak S, Greiss M (2000). "RhD haemolytic disease of the fetus and the newborn". Blood Rev. 14 (1): 44–61. doi:10.1054/blre.1999.0123. PMID 10805260.
- ↑ ೪೯.೦ ೪೯.೧ Fung Kee Fung K, Eason E, Crane J, Armson A, De La Ronde S, Farine D, Keenan-Lindsay L, Leduc L, Reid G, Aerde J, Wilson R, Davies G, Désilets V, Summers A, Wyatt P, Young D (2003). "Prevention of Rh alloimmunization". J Obstet Gynaecol Can. 25 (9): 765–73. PMID 12970812.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Tini M, Jewell UR, Camenisch G, Chilov D, Gassmann M (2002). "Generation and application of chicken egg-yolk antibodies". Comp. Biochem. Physiol., Part a Mol. Integr. Physiol. 131 (3): 569–74. doi:10.1016/S1095-6433(01)00508-6. PMID 11867282.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Cole SP, Campling BG, Atlaw T, Kozbor D, Roder JC (1984). "Human monoclonal antibodies". Mol. Cell. Biochem. 62 (2): 109–20. doi:10.1007/BF00223301. PMID 6087121.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Kabir S (2002). "Immunoglobulin purification by affinity chromatography using protein A mimetic ligands prepared by combinatorial chemical synthesis". Immunol Invest. 31 (3–4): 263–78. doi:10.1081/IMM-120016245. PMID 12472184.
- ↑ ೫೩.೦ ೫೩.೧ Brehm-Stecher B, Johnson E (2004). "Single-cell microbiology: tools, technologies, and applications". Microbiol Mol Biol Rev. 68 (3): 538–59. doi:10.1128/MMBR.68.3.538-559.2004. PMC 515252. PMID 15353569.
- ↑ Williams N (2000). "Immunoprecipitation procedures". Methods Cell Biol. 62: 449–53. doi:10.1016/S0091-679X(08)61549-6. PMID 10503210.
- ↑ Kurien B, Scofield R (2006). "Western blotting". Methods. 38 (4): 283–93. doi:10.1016/j.ymeth.2005.11.007. PMID 16483794.
- ↑ Scanziani E (1998). "Immunohistochemical staining of fixed tissues". Methods Mol Biol. 104: 133–40. doi:10.1385/0-89603-525-5:133. PMID 9711649.
- ↑ Reen DJ. (1994). "Enzyme-linked immunosorbent assay (ELISA)". Methods Mol Biol. 32: 461–6. doi:10.1385/0-89603-268-X:461. PMID 7951745.
- ↑ Kalyuzhny AE (2005). "Chemistry and biology of the ELISPOT assay". Methods Mol Biol. 302: 15–31. doi:10.1385/1-59259-903-6:015. PMID 15937343.
- ↑ Whitelegg N.R.J., Rees A.R. (2000). "WAM: an improved algorithm for modeling antibodies on the WEB". Protein Engineering. 13 (12): 819–824. doi:10.1093/protein/13.12.819. PMID 11239080.
WAM Archived 2011-07-17 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ. - ↑ Marcatili P, Rosi A,Tramontano A (2008). "PIGS: automatic prediction of antibody structures". Bioinformatics. 24 (17): 1953–1954. doi:10.1093/bioinformatics/btn341. PMID 18641403.
{{cite journal}}: CS1 maint: multiple names: authors list (link)
ಪ್ರಿಡಿಕ್ಷನ್ ಆಫ್ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಸ್ಟ್ರಕ್ಚರ್(PIGS) Archived 2010-11-26 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ. - ↑ Sivasubramanian A, Sircar A, Chaudhury S, Gray J J (2009). "Toward high-resolution homology modeling of antibody Fv regions and application to antibody–antigen docking". Proteins. 74 (2): 497–514. doi:10.1002/prot.22309. PMID 19062174.
{{cite journal}}: CS1 maint: multiple names: authors list (link)
ರೊಸೆಟ್ಟಾಆಂಟಿಬಾಡಿ - ↑ ೬೨.೦ ೬೨.೧ ೬೨.೨ Lindenmann, Jean (1984). "Origin of the Terms 'Antibody' and 'Antigen'". Scand. J. Immunol. 19 (4): 281–5. PMID 6374880. Archived from the original on 2010-11-18. Retrieved 2008-11-01.
- ↑ [166]
- ↑ [167]
- ↑ [168]
- ↑ "Emil von Behring - Biography". Retrieved 2007-06-05.
- ↑ AGN (1931). "The Late Baron Shibasaburo Kitasato". Canadian Medical Association Journal: 206.
- ↑ Winau F, Westphal O, Winau R (2004). "Paul Ehrlich--in search of the magic bullet". Microbes Infect. 6 (8): 786–9. doi:10.1016/j.micinf.2004.04.003. PMID 15207826.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Silverstein AM (2003). "Cellular versus humoral immunology: a century-long dispute". Nat. Immunol. 4 (5): 425–8. doi:10.1038/ni0503-425. PMID 12719732.
- ↑ Van Epps HL (2006). "Michael Heidelberger and the demystification of antibodies" (PDF). J. Exp. Med. 203 (1): 5. doi:10.1084/jem.2031fta. PMC 2118068. PMID 16523537.
- ↑ Marrack, JR (1938). Chemistry of antigens and antibodies (2nd ed.). London: His Majesty's Stationery Office. OCLC 3220539.
- ↑ "The Linus Pauling Papers: How Antibodies and Enzymes Work". Retrieved 2007-06-05.
- ↑ Silverstein AM (2004). "Labeled antigens and antibodies: the evolution of magic markers and magic bullets" (PDF). Nat. Immunol. 5 (12): 1211–7. doi:10.1038/ni1140. PMID 15549122. Archived from the original (PDF) on 2007-06-16. Retrieved 2010-08-13.
- ↑ Edelman GM, Gally JA (1962). "The nature of Bence-Jones proteins. Chemical similarities to polypetide chains of myeloma globulins and normal gamma-globulins". J. Exp. Med. 116: 207–27. doi:10.1084/jem.116.2.207. PMC 2137388. PMID 13889153.
- ↑ Stevens FJ, Solomon A, Schiffer M (1991). "Bence Jones proteins: a powerful tool for the fundamental study of protein chemistry and pathophysiology". Biochemistry. 30 (28): 6803–5. doi:10.1021/bi00242a001. PMID 2069946.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ ೭೬.೦ ೭೬.೧ Raju TN (1999). "The Nobel chronicles. 1972: Gerald M Edelman (b 1929) and Rodney R Porter (1917-85)". Lancet. 354 (9183): 1040. PMID 10501404.
- ↑ Tomasi TB (1992). "The discovery of secretory IgA and the mucosal immune system". Immunol. Today. 13 (10): 416–8. doi:10.1016/0167-5699(92)90093-M. PMID 1343085.
- ↑ Preud'homme JL, Petit I, Barra A, Morel F, Lecron JC, Lelièvre E (2000). "Structural and functional properties of membrane and secreted IgD". Mol. Immunol. 37 (15): 871–87. doi:10.1016/S0161-5890(01)00006-2. PMID 11282392.
{{cite journal}}: CS1 maint: multiple names: authors list (link) - ↑ Johansson SG (2006). "The discovery of immunoglobulin E". Allergy and asthma proceedings : the official journal of regional and state allergy societies. 27 (2 Suppl 1): S3–6. PMID 16722325.
- ↑ Hozumi N, Tonegawa S (1976). "Evidence for somatic rearrangement of immunoglobulin genes coding for variable and constant regions". Proc. Natl. Acad. Sci. U.S.A. 73 (10): 3628–32. doi:10.1073/pnas.73.10.3628. PMC 431171. PMID 824647.
ಬಾಹ್ಯ ಕೊಂಡಿಗಳು
[ಬದಲಾಯಿಸಿ]- ಮೈಕ್ಸ್ ಇಮ್ಯುನೊಗ್ಲಾಬ್ಯುಲಿನ್ ಸ್ಟ್ರಕ್ಚರ್/ಫಂಕ್ಷನ್ ಪೇಜ್ Archived 2007-04-03 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ. - ಕೇಂಬ್ರಿಡ್ಜ್ ವಿಶ್ವವಿದ್ಯಾನಿಲಯ
- ಆಂಟಿಬಾಡೀಸ್ ಆಸ್ ದಿ PDB ಮಾಲಿಕ್ಯೂಲ್ ಆಫ್ ದಿ ಮಂತ್ Archived 2010-04-14 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ. - ಪ್ರೋಟೀನ್ ಡೇಟಾ ಬ್ಯಾಂಕ್ನಲ್ಲಿ ಪ್ರತಿಕಾಯಗಳ ರಚನೆಯ ವಿವರಣೆ
- ಮೈಕ್ರೊಬಯಾಲಜಿ ಆಂಡ್ ಇಮ್ಯುನಾಲಜಿ ಆನ್ಲೈನ್ ಟೆಕ್ಸ್ಟ್ಬುಕ್ - ದಕ್ಷಿಣ ಕ್ಯಾರೊಲಿನಾದ ವಿಶ್ವವಿದ್ಯಾನಿಲಯ
- ಎ ಹಂಡ್ರೆಡ್ ಯಿಯರ್ಸ್ ಆಫ್ ಆಂಟಿಬಾಡಿ ಥೆರಪಿ - ಆಕ್ಸ್ಫರ್ಡ್ ವಿಶ್ವವಿದ್ಯಾನಿಲಯದಲ್ಲಿ, ಕಾಯಿಲೆಯ ಚಿಕಿತ್ಸೆಯಲ್ಲಿ ಪ್ರತಿಕಾಯಗಳ ಇತಿಹಾಸ ಮತ್ತು ಅನ್ವಯಗಳು
- ಹೌ ಲಿಂಫೊಸೈಟ್ಸ್ ಪ್ರೊಡ್ಯೂಸ್ ಆಂಡಿಬಾಡಿ - ಸೆಲ್ಸ್ ಅಲೈವ್
- ಆಂಟಿಬಾಡಿ ಅಪ್ಲಿಕೇಶನ್ಸ್ Archived 2009-09-25 ವೇಬ್ಯಾಕ್ ಮೆಷಿನ್ ನಲ್ಲಿ. - ಫ್ಲೋರೆಸೆಂಟ್ ಪ್ರತಿಕಾಯ ಚಿತ್ರಣ ಲೈಬ್ರರಿ, ಬರ್ಮಿಂಗ್ಹ್ಯಾಮ್ ವಿಶ್ವವಿದ್ಯಾನಿಲಯ
- Pages using the JsonConfig extension
- CS1 maint: multiple names: authors list
- CS1 errors: explicit use of et al.
- CS1 errors: unsupported parameter
- CS1 maint: unflagged free DOI
- CS1 errors: URL–wikilink conflict
- CS1 maint: extra punctuation
- CS1: long volume value
- ವೆಬ್ ಆರ್ಕೈವ್ ಟೆಂಪ್ಲೇಟಿನ ವೇಬ್ಯಾಕ್ ಕೊಂಡಿಗಳು
- Articles with links needing disambiguation
- Commons category link is on Wikidata
- ಗ್ಲೈಕೊಪ್ರೋಟೀನ್ಗಳು
- ಪ್ರತಿರಕ್ಷಣಾ ವ್ಯವಸ್ಥೆ
- ಜೀವಶಾಸ್ತ್ರ
