ಅಮಿನೊ ಆಮ್ಲ


ಅಮಿನೊ ಆಮ್ಲಗಳು[ಟಿಪ್ಪಣಿ ೧] (ಅಮೈನೊ ಆಮ್ಲ) ಜೈವಿಕವಾಗಿ ಮುಖ್ಯವಾದ ಅಮೈನ್ (-NH2) ಮತ್ತು ಕಾರ್ಬೋಕ್ಸಿಲಿಕ್ ಆಮ್ಲ (-COOH) ಕ್ರಿಯಾ ಗುಂಪುಗಳಿರುವ ಸಾವಯವ ಸಂಯುಕ್ತಗಳು. ಅಲ್ಲದೆ ಸಾಮಾನ್ಯವಾಗಿ ಪ್ರತಿ ಅಮಿನೊ ಆಮ್ಲಕ್ಕೂ ವಿಶಿಷ್ಟವಾಗಿರುವ ಪಕ್ಕದ-ಸರಪಳಿ ಸಹ ಇರುತ್ತದೆ.[೧][೨][೩] ಅಮಿನೊ ಆಮ್ಲದ ಪ್ರಮುಖ ಧಾತುಗಳು ಇಂಗಾಲ, ಜಲಜನಕ, ಆಮ್ಲಜನಕ ಮತ್ತು ಸಾರಜನಕಗಳು. ಆದರೆ ಕೆಲವೊಂದು ಅಮಿನೊ ಆಮ್ಲಗಳ ಪಕ್ಕದ-ಸರಪಳಿಯಲ್ಲಿ ಬೇರೆ ಧಾತುಗಳಿರುತ್ತವೆ. ಸುಮಾರು ೫೦೦ ಅಮಿನೊ ಆಮ್ಲಗಳು ತಿಳಿದಿದ್ದು ಅವನ್ನು ಹಲವು ರೀತಿಯಲ್ಲಿ ವರ್ಗೀಕರಿಸಲಾಗುತ್ತದೆ.[೪] ಅವನ್ನು ಪ್ರಮುಖ ರಾಚನಿಕ ಕ್ರಿಯಾ ಗುಂಪುಗಳ ಇರುವಿಕೆಯ ಸ್ಥಾನದ ಆಧಾರದ ಮೇಲೆ ಆಲ್ಫಾ(α), ಬೀಟಾ (β), ಗಾಮ (γ) ಅಥವಾ ಡೆಲ್ಟಾ (δ)[ಟಿಪ್ಪಣಿ ೨] ಅಮಿನೊ ಆಮ್ಲಗಳೆಂದು ವರ್ಗೀಕರಿಸಬಹುದು. ಇತರ ವರ್ಗೀಕರಣಗಳು ಧ್ರುವೀಯತೆ, ಪಿಹೆಚ್ ಮಟ್ಟ ಅಥವಾ ಪಕ್ಕದ-ಸರಪಣಿಗಳ ಗುಂಪಿನ ನಮೂನೆಯ ಮೇಲೆ ವರ್ಗೀಕರಿಸುವುದನ್ನು ಒಳಗೊಂಡಿದೆ. ಪ್ರೋಟೀನ್ನ ರೂಪದಲ್ಲಿ ಮಾನವನ ಸ್ನಾಯುಗಳು, ಜೀವಕೋಶಗಳು ಮತ್ತು ಅಂಗಾಶಗಳಲ್ಲಿ ಕಂಡು ಬರುವ ಎರಡನೆಯ ದೊಡ್ಡ ಅಂಶ ಅಮಿನೊ ಆಮ್ಲಗಳು (ಮೊದಲನೆಯನದು ನೀರು).[೫] ಪ್ರೋಟೀನ್ ಹೊರಗೆ ಅಮಿನೊ ಆಮ್ಲಗಳಿಗೆ ನರಪ್ರೇಕ್ಷಕ[ಟಿಪ್ಪಣಿ ೩] ರವಾನೆ ಮತ್ತು ಜೈವಿಕ ಸಂಯೋಜನೆಗಳಂತಹ[ಟಿಪ್ಪಣಿ ೪] ಪ್ರಮುಖ ಪ್ರಕ್ರಿಯೆಗಳಲ್ಲಿ ಪಾತ್ರವಿದೆ.
ಜೀವರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿ ಅಮೈನ್ ಮತ್ತು ಕಾರ್ಬೋಕ್ಸಿಲಿಕ್ ಗುಂಪುಗಳು ಮೊದಲನೆಯ ಅಥವಾ (ಆಲ್ಫಾ) ಇಂಗಾಲ ಅಣುವಿಗೆ ಅಂಟಿಕೊಳ್ಳುವುದು ಅಮಿನೊ ಆಮ್ಲಗಳಲ್ಲಿ ಮಹತ್ವ ಪಡೆದಿದೆ. ಇವನ್ನು ೨-, ಆಲ್ಫಾ ಅಥವಾ α-ಅಮಿನೊ ಆಮ್ಲ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. (ಬಹಳಷ್ಟು ಅಮಿನೊ ಆಮ್ಲಗಳ ಸಾಮಾನ್ಯ ಸೂತ್ರ H2NCHRCOOH.[೬] ಇಲ್ಲಿ R ಒಂದು ಆದೇಶ್ಯ[ಟಿಪ್ಪಣಿ ೫] ಮತ್ತು ಇದನ್ನು “ಪಕ್ಕದ-ಸರಣಿ” ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.[೭] ಕೆಲವೊಮ್ಮೆ “ಅಮಿನೊ ಆಮ್ಲ” ಪದವನ್ನು ನಿರ್ದಿಷ್ಟವಾಗಿ ಇವಕ್ಕೆ ಬಳಸಲಾಗುತ್ತದೆ.) ಇವು ಒಂದಕ್ಕೊಂದು ದೊಡ್ಡ ಸಮೂಹಗಳಾಗಿ ಸೇರಿ ಪೆಪ್ಟೈಡ್ ಸರಪಣಿಯಾಗುವ (ಪಾಲಿಪೆಪ್ಟೈಡ್)[೮] ಮೂಲಕ ಪ್ರೋಟೀನ್ಗಳಾಗುವ ೨೩ ಪ್ರೋಟಿನೊಜನಕ (ಪ್ರೋಟೀನ್ ರಚಿಸುವ) ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಒಳಗೊಂಡಿವೆ.[೯][೧೦][೧೧] ಇವೆಲ್ಲವು ಎಲ್-ಸಮಸ್ಥಾನಿಕಗಳು.[ಟಿಪ್ಪಣಿ ೬] ಕೆಲವು ಡಿ-ಅಮಿನೊ ಆಮ್ಲಗಳು (ಬಲಗೈಯ) ಇದ್ದು ನ್ಯೂರೋಮಾಡುಲೇಟರ್ (ಡಿ-ಸೆರಿನ್) ಆಗಿ ಬ್ಯಾಕ್ಟೀರಿಯದ ಕವಚದಲ್ಲಿಯೂ ಮತ್ತು ಕೆಲವೊಂದು ಪ್ರತಿಜೀವಕಗಳಲ್ಲಿಯೂ ಇರುತ್ತವೆ.[೧೨] ಇಪ್ಪತ್ತು ಪ್ರೋಟೀನ್ಜನಕ ಅಮಿನೊ ಆಮ್ಲಗಳು ಜೆನೆಟಿಕ್ ಕೋಡ್ನಲ್ಲಿ ನೇರವಾಗಿ ತ್ರಿವಳಿಗಳಾಗಿ ಸಂಕೇತಿಸಲ್ಪಟ್ಟಿವೆ ಮತ್ತು ಇವನ್ನು “ಪ್ರಮಾಣಕ” ಅಥವಾ ಸ್ಟಾಂಡರ್ಡು ಅಮಿನೊ ಆಮ್ಲಗಳೆಂದು ಕರೆಯಲಾಗಿದೆ. ಇತರ ಮೂರು (“ಪ್ರಮಾಣಕವಲ್ಲದ” ಅಥವಾ “ಅಧಿಕೃತವಲ್ಲದ”) ಪ್ರೋಟೀನೊಜನಕ ಅಮಿನೊ ಆಮ್ಲಗಳು ಸೆಲೆನೊಸಿಸ್ಟೇಯಿನ್ (ಹಲವು ಯೂಕ್ಯಾರಿಯೋಟ್ಗಳು ಅಲ್ಲದ ಜೀವಿಗಳಲ್ಲಿಯೂ ಮತ್ತು ಬಹಳಷ್ಟು ಯೂಕ್ಯಾರಿಯೋಟ್ಗಳಲ್ಲಿಯೂ ಇರುತ್ತದೆ, ಇದು ನೇರವಾಗಿ ಡಿಎನ್ಎಯಿಂದ ಸಂಕೇತಿಸಲ್ಪಟ್ಟಿಲ್ಲ), ಪೈರ್ರೋಲೈಸಿನ್ (ಒಂದು ಬ್ಯಾಕ್ಟೀರಿಯ ಮತ್ತು ಕೆಲವು ಆರ್ಕಿಯಗಳಲ್ಲಿ ಮಾತ್ರ ಕಂಡುಬರುತ್ತದೆ) ಮತ್ತು ಎನ್-ಫಾರ್ಮೈಲ್ಮಿಥಿಯೊನಿನ್ (ಕೆಲವೊಮ್ಮೆ ಬ್ಯಾಕ್ಟೀರಿಯ, ಮೈಟೊಕಾಂಡ್ರಿಯನ್ ಮತ್ತು ಹರಿದ್ರೇಣುವಿನಲ್ಲಿನ ಪ್ರೋಟೀನ್ಗಳ ಆರಂಭಿಕ ಅಮಿನೊ ಆಮ್ಲ). ಪೈರ್ರೋಲೈಸಿನ್ ಮತ್ತು ಸೆಲೆನೊಸಿಸ್ಟೇಯಿನ್ಗಳು ಭಿನ್ನ ಕೋಡಾನಿನಲ್ಲಿ ಸಂಕೇತಿಸಲ್ಪಟ್ಟಿವೆ. ಉದಾಹರಣೆಗೆ ಸೆಲೆನೊಸಿಸ್ಟೇಯಿನ್ ನಿಲ್ಲಿಸು ಕೋಡಾನು{ಜೆನೆಟಿಕ್ ಕೋಡ್ನಲ್ಲಿ ಮೂರು ನಿಲ್ಲಿಸು ಕೋಡಾನುಗಳಿರುತ್ತವೆ.} ಮತ್ತು SECIS ಅಂಶದಿಂದ ಸಂಕೇತಿಸಲ್ಪಟ್ಟಿದೆ.[೧೩][೧೪][೧೫] ಪ್ರಕೃತಿಯಲ್ಲಿ ಕಾಣಬರದ ಕೋಡಾನು-ಟಿಆರ್ಎನ್ಎ ಸಂಯೋಗವನ್ನು ಬಳಸಿ ಪ್ರೋಟೀನ್ಜನಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಬಳಸಿ ಅಲೊಪ್ರೋಟೀನ್ಗಳೆಂದು ಕರೆಯಲಾದ ಹೊಸ ಪ್ರೋಟೀನ್ಗಳನ್ನು ತಯಾರಿಸಬಹುದು.[೧೬][೧೭][೧೮]
ಹಲವು ಪ್ರಮುಖ ಪ್ರೋಟಿನೊಜನಕ ಮತ್ತು ಪ್ರೋಟಿನೋಜನಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು ದೇಹದಲ್ಲಿ ಬೇರೆ ಪ್ರೋಟೀನ್ನೇತರ ಪ್ರಮುಖ ಪಾತ್ರಗಳನ್ನು ನಿರ್ವಹಿಸುತ್ತವೆ. ಉದಾಹರಣೆಗೆ ಮಾನವನ ಮಿದುಳಿನಲ್ಲಿ ಗ್ಲುಟಮೇಟ್ (ಪ್ರಮಾಣಕ ಗ್ಲುಟಾಮಿಕ್ ಆಮ್ಲ) ಮತ್ತು ಗಾಮ-ಅಮಿನೊ-ಬುಟೈರಿಕ್ ಆಮ್ಲ (“ಜಿಎಬಿಎ” ಪ್ರಮಾಣಿಕವಲ್ಲದ ಗಾಮ ಅಮಿನೊ ಆಮ್ಲ) ಕ್ರಮವಾಗಿ ಪ್ರಚೋದಕ ಮತ್ತು ಪ್ರತಿಬಂಧಕ ನರಪ್ರೇಕ್ಷಕಗಳಾಗಿ[ಟಿಪ್ಪಣಿ ೩] ಕೆಲಸಮಾಡುತ್ತವೆ.[೧೯] ಹೈಡ್ರೊಕ್ಸಿಪ್ರೊಲಿನ್ (ಸಂಯೋಜಕ ಅಂಗಾಂಶ ಕಾಲಜನ್ನ ಪ್ರಮುಖ ಅಂಶ) ಪ್ರೊಲಿನ್ನಿಂದ ಸಂಯೋಜಿತವಾಗುತ್ತದೆ. ಕೆಂಪು ರಕ್ತ ಕಣಗಳಲ್ಲಿ ಬಳಕೆಯಾಗುವ ಪೋರ್ಫೈರಿನ್ಗಳು ಪ್ರಮಾಣಕ ಅಮಿನೊ ಆಮ್ಲ ಗ್ಲೈಸಿನ್ನಿಂದ ಸಂಯೋಜಿತವಾಗುತ್ತವೆ. ಪ್ರಮಾಣಕವಲ್ಲದ ಕಾರ್ನಿಟಿನ್ ಲಿಪಿಡ್ ಅಥವಾ ಮೇದಸ್ಸುಗಳ ರವಾನೆಯಲ್ಲಿ ಬಳಕೆಯಾಗುತ್ತದೆ.
ಒಂಬತ್ತು ಪ್ರೋಟಿನೊಜನಕ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು “ಅವಶ್ಯಕ” ಅಮಿನೊ ಆಮ್ಲಗಳೆಂದು ಕರೆಯಲಾಗಿದೆ. ಇವುಗಳನ್ನು ಮಾನವನ ದೇಹದಲ್ಲಿ ಇತರ ಸಂಯುಕ್ತಗಳನ್ನು ಬಳಸಿ ತಯಾರಿಸಲು ಆಗುವುದಿಲ್ಲ ಮತ್ತು ಆದ್ದರಿಂದ ಆಹಾರದ ಮೂಲಕ ತೆಗೆದುಕೊಳ್ಳಬೇಕು. ಇತರ ಅಮಿನೊ ಆಮ್ಲಗಳು ಕೆಲವು ಸಂದರ್ಭಗಳಲ್ಲಿ (ಕೆಲವು ವಯಸ್ಸಿನಲ್ಲಿ ಮತ್ತು ವೈದಕೀಯ ಸ್ಥಿತಿಯಲ್ಲಿ) ಮಾತ್ರ ಅವಶ್ಯವಾಗುತ್ತವೆ. ಅವಶ್ಯ ಅಮಿನೊ ಆಮ್ಲಗಳು ಜೀವಸಂಕುಲದಿಂದ ಜೀವಸಂಕುಲಕ್ಕೆ ಬೇರೆ ಬೇರೆಯಾಗಬಹುದು.[೨೦]
ಪೋಷಕಾಂಶಗಳಲ್ಲಿ ಅಮಿನೊ ಆಮ್ಲಗಳ ಜೈವಿಕ ಮಹತ್ವದ ಹಿನ್ನೆಲೆಯಲ್ಲಿ ಸಾಧಾರಣವಾಗಿ ಪೋಷಕಾಂಶಗಳ ಪೂರಕಗಳಾಗಿ, ಗೊಬ್ಬರಗಳಾಗಿ ಮತ್ತು ಆಹಾರ ತಂತ್ರಜ್ಞಾನದಲ್ಲಿ ಬಳಕೆಯಾಗುತ್ತವೆ. ಅವುಗಳ ಕೈಗಾರಿಕಾ ಬಳಕೆ ಔಷಧಿಗಳ, ಜೈವಿಕ ವಿಘಟನೀಯ ಪ್ಲಾಸ್ಟಿಕ್ಗಳ ಮತ್ತು ಕೈರಲ್[ಟಿಪ್ಪಣಿ ೭] ವೇಗವರ್ಧಕಗಳ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಇದೆ.
ಇತಿಹಾಸ
[ಬದಲಾಯಿಸಿ]ಮೊದಲ ಕೆಲವು ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಆರಂಭಿಕ ೧೯ನೆಯ ಶತಮಾನದಲ್ಲಿ ಕಂಡುಹಿಡಿಯಲಾಯಿತು. ೧೮೦೬ರಲ್ಲಿ ಫ್ರೆಂಚ್ ರಸಾಯನಿಕಶಾಸ್ತ್ರಜ್ಞರಾದ ಲೂಯಿಸ್-ನಿಕೊಲಸ್ ವ್ಯಾಕ್ಯೂಲಿನ್ ಮತ್ತು ಪಿಯರಿ ಜೀನ್ ರೊಬಿಕ್ವೆಟ್ ಆಸ್ಪರಗಸ್ ಎನ್ನುವ ಸಂಯುಕ್ತವನ್ನು ಪ್ರತ್ಯೇಕಿಸಿದರು ನಂತರ ಇದನ್ನು ಅಸ್ಪರಜಿನ್ ಎಂದು ಹೆಸರಿಸಲಾಯಿತು. ಇದು ಮೊದಲು ಕಂಡುಹಿಡಿದ ಅಮಿನೊ ಆಮ್ಲ.[೨೧][೨೨] ಸಿಸ್ಟೈನ್ನನ್ನು ೧೮೧೦ರಲ್ಲಿ ಕಂಡುಹಿಡಿಯಲಾಯಿತು[೨೩] ಆದರೆ ಅದರ ಮೊನೊಮರ್[ಟಿಪ್ಪಣಿ ೮] ಸಿಸ್ಟೇಯಿನ್ ೧೮೮೪ರ ವರೆಗೂ ಕಂಡುಹಿಡಿಯಲ್ಪಡಲಿಲ್ಲ.[೨೨][೨೪] ಗ್ಲೈಸಿನ್ ಮತ್ತು ಲುಸಿನ್ಗಳನ್ನು ೧೮೨೦ರಲ್ಲಿ ಕಂಡುಹಿಡಿಯಲಾಯಿತು.[೨೫] ೨೦ ಸಾಮಾನ್ಯ ಅಮಿನೊ ಆಮ್ಲಗಳಲ್ಲಿ ಥ್ರೆಯೊನಿನ್ ಕೊನೆಯದಾಗಿ ಕಂಡುಹಿಡಿದ ಅಮಿನೊ ಆಮ್ಲ. ಇದನ್ನು ೧೯೩೫ರಲ್ಲಿ ಕಂಡುಹಿಡಿದ ವಿಲಿಯಂ ಕಮ್ಮಿಂಗ್ ರೋಸ್ ಅವಶ್ಯಕ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಗುರುತಿಸಿದ ಮತ್ತು ಅತ್ಯುತ್ತಮ ಬೆಳವಣಿಗೆಗೆ ಅಗತ್ಯವಾದ ಕನಿಷ್ಠ ದಿನವಹಿ ಅಗತ್ಯವನ್ನು ಅಂದಾಜಿಸಿದ.[೨೬][೨೭]
ಪ್ರೋಟೀನ್ಗಳು ಕಿಣ್ವಿಕದ ಅರಗುವಿಕೆ ಅಥವಾ ಆಮ್ಲದ ಜಲವಿಚ್ಛೇದನೆ ಅಥವಾ ಹೈಡ್ರೊಲೈಸಿಸ್[ಟಿಪ್ಪಣಿ ೯] ನಂತರ ಅಮಿನೊ ಆಮ್ಲಗಳು ಉಂಟಾಗುವುದನ್ನು ಗಮನಿಸಲಾಗಿತ್ತು. ೧೯೦೨ರಲ್ಲಿ ಎಮಿಲ್ ಫಿಸ್ಕರ್ ಮತ್ತು ಫ್ಯಾಂಜ್ ಹೊಫ್ಮೆಯಿಸ್ಟರ್ ಪ್ರೋಟೀನ್ಗಳು ಒಂದು ಅಮಿನೊ ಆಮ್ಲದ ಅಮಿನೊ[ಟಿಪ್ಪಣಿ ೧೦] ಗುಂಪು ಇನ್ನೊಂದು ಅಮಿನೊ ಆಮ್ಲದ ಕಾರ್ಬೋಕ್ಸಿಲ್ ಗುಂಪಿನ ನಡುವೆ ಬಂಧ ಏರ್ಪಡುವ ಮೂಲಕ ಆಗುತ್ತವೆ ಎಂದು ಸೂಚಿಸಿದ ಮತ್ತು ಈ ರೇಖೆರೀತಿಯ ರಚನೆಗೆ ಫಿಸ್ಕರ್ “ಪೆಪ್ಟೈಡ್” ಎಂದು ಕರೆದ.[೨೮]
ಸಾಮಾನ್ಯ ರಚನೆ
[ಬದಲಾಯಿಸಿ]ಮೇಲೆ ತೋರಿಸಲಾದ ರಚನೆಯಲ್ಲಿನ R ಪಕ್ಕದ-ಸರಣಿಯನ್ನು ಪ್ರತಿನಿಧಿಸುತ್ತಿದ್ದು ಇದು ಪ್ರತಿ ಅಮಿನೊ ಆಮ್ಲಕ್ಕೂ ವಿಶಿಷ್ಟವಾಗಿದೆ. ಕಾರ್ಬೋಕ್ಸಿಲ್ ಗುಂಪಿನ ನಂತರದ ಇಂಗಾಲವನ್ನು (ಇದು ಕ್ರಿಯಾ ಗುಂಪಿನಿಂದ ಆರಂಭವಾಗುವ ಇಂಗಾಲ ಸರಪಳಿಯ ೨ನೆಯ ಇಂಗಾಲದ ಪರಮಾಣು) α-ಇಂಗಾಲವೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಅಮಿನೊ ಆಮ್ಲಗಳಲ್ಲಿ ಅಮಿನೊ ಗುಂಪು ನೇರವಾಗಿ ಆಲ್ಫಾ ಇಂಗಾಲದಿಂದ ಬಂಧಿತವಾಗಿದ್ದರೆ ಅವನ್ನು ಆಲ್ಫಾ ಅಮಿನೊ ಆಮ್ಲಗಳೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ.[೨೯] ಪ್ರೊಲಿನ್ಗಳಂತಹ ಕೆಲವು ಅಮಿನೊ ಆಮ್ಲಗಳಲ್ಲಿ ಎರಡನೆಯ ಅಮಿನ್ ಇರುತ್ತದೆ, ಹೀಗಾಗಿ ಕೆಲವೊಮ್ಮೆ ಇದನ್ನು “ಇಮಿನೊ ಆಮ್ಲ”ಗಳೆಂದು ಕರೆಯಲಾಗಿದೆ.[೩೦][೩೧][೩೨]
ಸಮಾಂಗತೆ
[ಬದಲಾಯಿಸಿ]
ಆಲ್ಫಾ ಅಮಿನೊ ಆಮ್ಲಗಳು ನಿಸರ್ಗದಲ್ಲಿ ಬಹಳ ಸಾಮಾನ್ಯವಾಗಿವೆ ಆದರೆ ಅವುಗಳ ಎಲ್-ಸಮಾಂಗಿಗಳಾಗಿ ಮಾತ್ರ. ಎರಡು ಬೇರೆಯಾಗಿ ಗುರುತಿಸಲಾಗದ ಜಲಜನಕ ಪರಮಾಣುಗಳು ಇರುವ ಗ್ಲೈಸಿನ್ ಹೊರತು ಪಡಿಸಿ ಉಳಿದೆಲ್ಲವು ಆಲ್ಫಾ ಕೈರಲ್[ಟಿಪ್ಪಣಿ ೭] ಇಂಗಾಲ ಪರಮಾಣುಗಳು.[೩೩] ಹೀಗಾಗಿ ಗ್ಲೈಸಿನ್ ಹೊರತು ಪಡಿಸಿ ಎಲ್ಲಾ ಅಮಿನೊ ಆಮ್ಲಗಳು ಎರಡು ಪ್ರತ್ಯಂಗಿಗಳ[ಟಿಪ್ಪಣಿ ೧೧] ರೂಪದಲ್ಲಿರುತ್ತವೆ ಮತ್ತು ಇವನ್ನು ಎಲ್-ಅಮಿನೊ ಆಮ್ಲ ಮತ್ತು ಡಿ-ಅಮಿನೊ ಆಮ್ಲ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಪಕ್ಕದ ಸರಪಳಿ
[ಬದಲಾಯಿಸಿ]
ಅಮಿನೊ ಆಮ್ಲದ ಇಂಗಾಲ ಸರಪಣಿಯು α-ಇಂಗಾಲಕ್ಕೆ ಅಂಟಿಕೊಂಡಿರುತ್ತದೆ (ಬಲಗಡೆ ತೋರಿಸಿದ ಲೈಸಿನ್ನಲ್ಲಿನಂತೆ). ಈ ಇಂಗಾಲಗಳನ್ನು α, β, γ, δ ಮುಂತಾದ ಹೆಸರು ಕೊಡಲಾಗುತ್ತದೆ.[೩೪] ಕೆಲವು ಅಮಿನೊ ಆಮ್ಲಗಳಲ್ಲಿನ ಅಮಿನ್ ಗುಂಪು β, γ-ಇಂಗಾಲಕ್ಕೆ ಅಂಟಿಕೊಂಡಿರ ಬಹುದು ಮತ್ತು ಹೀಗಿದ್ದಲ್ಲಿ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಬಿಟಾ ಅಥವಾ ಗಾಮಾ ಅಮಿನೊ ಆಮ್ಲಗಳೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಸಾಮಾನ್ಯವಾಗಿ ಅವುಗಳ ಪಕ್ಕದ-ಸರಪಳಿಯ ಗುಣಗಳ ಮೇಲೆ ನಾಲ್ಕು ಗುಂಪುಗಳಾಗಿ ವರ್ಗೀಕರಿಸಲಾಗಿದೆ. ಪಕ್ಕದ-ಸರಪಳಿಯು ಅಮಿನೊ ಆಮ್ಲವನ್ನು ಬಲಹೀನ ಆಮ್ಲ ಅಥವಾ ಬಲಹೀನ ಪ್ರತ್ಯಾಮ್ಲವಾಗಿ ಮಾಡಬಹುದು ಮತ್ತು ಪಕ್ಕದ-ಸರಪಳಿಯು ಧ್ರುವೀಯವಾಗಿದ್ದರೆ (ವಿದ್ಯುತ್-ವೇಲೆನ್ಸಿ ಹೊಂದಿದ್ದರೆ) ನೀರಿನಿಂದ ಆಕರ್ಷಿತವಾಗುತ್ತದೆ (ಹೈಡ್ರೋಫೈಲ್) ಅಥವಾ ಧ್ರುವೀಯತೆ ಗೈರಲ್ಲಿ ನೀರಿನಿಂದ ವಿಕರ್ಷಿಸಲ್ಪಡುತ್ತದೆ[ಟಿಪ್ಪಣಿ ೧೨][೩೩]
ದೊರೆಯುವ ರೀತಿ ಮತ್ತು ಜೀವರಸಾಯನಾಶಾಸ್ತ್ರದಲ್ಲಿನ ಕಾರ್ಯನಿರ್ವಹಣೆ
[ಬದಲಾಯಿಸಿ]
ಪ್ರೋಟೀನೊಜನಕ ಅಮಿನೊ ಆಮ್ಲಗಳು
[ಬದಲಾಯಿಸಿ]ಅಮಿನೊ ಆಮ್ಲಗಳು ಪ್ರೋಟೀನ್ನ ರಾಚನಿಕ ಘಟಕಗಳು. ಅವು ಒಂದನ್ನೊಂದು ಸೇರಿ ಪೆಪ್ಟೈಡ್ಗಳೆಂದು ಕರೆಯಲಾದ ಸಣ್ಣ ಪಾಲಿಮರ್ ಸರಪಳಿಗಳಾಗಬಹುದು ಅಥವಾ ದೊಡ್ಡ ಪಾಲಿಪೆಪ್ಟೈಡ್ಗಳು ಅಥವಾ ಪ್ರೋಟೀನ್ಗಳಾಗಬಹುದು. ಅಮಿನೊ ಆಮ್ಲದ ಈ ಪಾಲಿಮರ್ಗಳು ಉದ್ದನೆಯವು ಮತ್ತು ಕವಲೊಡೆದಿರುವುದಿಲ್ಲ. ಸರಪಳಿಯಲ್ಲಿನ ಪ್ರತಿ ಅಮಿನೊ ಆಮ್ಲವು ಎರಡು ಪಕ್ಕದ ಅಮಿನೊ ಆಮ್ಲಗಳಿಗೆ ಅಂಟಿಕೊಂಡಿರುತ್ತದೆ. ಪ್ರೋಟಿನಿಗಾಗಿ ಬೇಕಿರುವ ಎಲ್ಲ ಅಮೈನೋ ಆಮ್ಲಗಳೂ ಒಟ್ಟಾಗಿ ದೊರೆತರೆ ಮಾತ್ರ ಶರೀರದಲ್ಲಿ ಅವುಗಳ ತಯಾರಿಕೆ ಬಲುಬೇಗನೆ ಆಗುವುದು. ಅರೆಬರೆ ಪ್ರೋಟೀನನ್ನು ತಯಾರಿಸಿ ಇಟ್ಟುಕೊಂಡು, ಕೊರೆಯಾಗಿರುವ ಅಮೈನೋ ಆಮ್ಲಗಳಿಗಾಗಿ ಶರೀರ ಕಾದಿರದು. ಪ್ರೋಟೀನಿನಲ್ಲಿ ಅಮೈನೋ ಆಮ್ಲಗಳು ಒಂದು ಗೊತ್ತಾದ ಕ್ರಮದ ಜೋಡಣೆ ವಂಶಗುಣಗಳ ತಿಳುವಳಿಕೆಯಂತೆ ಇರುವುದು. ಪ್ರೋಟೀನ್ ತಯಾರಿಸುವ ಪ್ರಕ್ರಿಯೆಗೆ ಅನುವಾದ ಎಂದು ಹೆಸರು (ವಿವರಗಳಿಗೆ ಪ್ರೋಟೀನ್ ಜೈವಿಕ ಸಂಯೋಜನೆ ನೋಡಿ). ಇದು ಬೆಳೆಯುತ್ತಿರುವ ಪ್ರೋಟೀನ್ ಸರಪಣಿಗೆ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಸೇರಿಸುವ ಹೆಜ್ಜೆಗಳನ್ನು ಒಳಗೊಂಡಿದ್ದು ಇದನ್ನು ರೈಬೊಜೈಮ್ ಎಂದು ಕರೆಯಲಾದ ರೈಬೋಸೋಮ್ ಮಾಡುತ್ತದೆ.[೩೫] ಅಮಿನೊ ಆಮ್ಲಗಳ ಸೇರಿಸುವ ಅನುಕ್ರಮಕ್ಕಾಗಿ ಎಂಆರ್ಎನ್ಎ ಪಡಿಯಚ್ಚನ್ನು (ಜೀವಿಯ ಎರಡು ವಂಶವಾಹಿಗಳಲ್ಲಿ ಒಂದರ ಆರ್ಎನ್ಎ ನಕಲು) ಜೆನಿಟಿಕ್ ಕೋಡ್ ಮೂಲಕ ಓದುತ್ತದೆ. ಇಲ್ಲಿನ ತನಕ ಗೊತ್ತಿರುವಂತೆ, ತಿಳುವಳಿಕೆ ಪ್ರೊಟೀನಿನ ಮೊದಲ ರಚನಾಕ್ರಮವನ್ನು ನಿರ್ಧರಿಸುವುದು. ಪ್ರೊಟೀನಿನ ಆಮೇಲಿನ ರಚನೆ ಈ ಮೊದಲ ಕ್ರಮವನ್ನೇ ಅವಲಂಬಿಸಿರುವುದು.
ಪಾಲಿಪೆಪ್ಟೈಡ್ಗಳಲ್ಲಿ ನೈಸರ್ಗಿಕವಾಗಿ ಸೇರಿಸಲಾಗುವ ಇಪ್ಪತ್ತೆರಡು ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಪ್ರೋಟೀನೊಜನಕ ಅಥವಾ ನೈಸರ್ಗಿಕ ಅಮಿನೊ ಆಮ್ಲಗಳು ಎಂದು ಕರೆಯಲಾಗಿದೆ. ಇವುಗಳಲ್ಲಿ ಇಪ್ಪತ್ತನ್ನು ಸಾರ್ವತ್ರಿಕ ಜೆನೆಟಿಕ್ ಕೋಡ್ ಸಂಕೇತಿಸುತ್ತದೆ. ಉಳಿದ ಎರಡು ಸೆಲೆನೊಸಿಸ್ಟೆಯಿನ್ ಮತ್ತು ಪೈರ್ರೋಲೈಸಿನ್. ಇವು ಪ್ರೋಟೀನ್ನಲ್ಲಿ ವಿಶಿಷ್ಟ ಸಂಯೋಜನೆಯ ಮೆಕಾನಿಸಂ ಮೂಲಕ ಸೇರಿಸಲ್ಪಡುತ್ತವೆ. ಅನುವಾದಿಸಲ್ಪಡುವ ಎಂಆರ್ಎನ್ಎಯಲ್ಲಿ SECIS ಅಂಶವಿದ್ದರೆ ಆ UGA ಕೊಡಾನು ನಿಲ್ಲಿಸು ಕೋಡಾನು ಆಗದೆ ಸೆಲೆನೊಸಿಸ್ಟೇಯಿನ್ ಸಂಕೇತಿಸುವ ಕೋಡಾನಾಗುತ್ತದೆ.[೩೬] ಕೆಲವು ಮಿಥೇನ್ಜನಕ ಆರ್ಕಿಯಗಳಲ್ಲಿ ಮಿಥೇನ್ ಉತ್ಪಾದಿಸುವ ಕಿಣ್ವಗಳು ಪೈರ್ರೋಲೈಸಿನ್ ಬಳಸುತ್ತವೆ. ಇದು UAGಯಲ್ಲಿ ಸಂಕೇತಿಸಲ್ಪಟ್ಟಿದ್ದು ಇತರ ಜೀವಿಗಳಲ್ಲಿ ಇದು ನಿಲ್ಲಿಸು ಕೋಡಾನು.[೩೭]
ಪ್ರೋಟೀನೊಜನಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು
[ಬದಲಾಯಿಸಿ]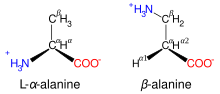
೨೨ ಪ್ರೋಟೀನೊಜನಕ ಅಮಿನೊ ಆಮ್ಲಗಳಲ್ಲದೆ ಪ್ರೋಟೀನೊಜನಕವಲ್ಲದ ಹಲವು ಅಮಿನೊ ಆಮ್ಲಗಳಿವೆ. ಕೆಲವು ಪ್ರೋಟೀನ್ಗಳಲ್ಲಿ ಕಂಡುಬರುವುದಿಲ್ಲ (ಉದಾಹರಣೆಗೆ ಕಾರ್ನಿಟಿನ್ ಮತ್ತು ಜಿಎಬಿಎ ಅಥವಾ ಗಾಮ-ಅಮಿನೊ-ಬುಟೈರಿಕ್ ಆಮ್ಲ) ಅಥವಾ ಪ್ರಮಾಣಕ ಜೀವಕೋಶದ ಯತ್ರಾಂಗವು ನೇರವಾಗಿ ಮತ್ತು ಪ್ರತ್ಯೇಕವಾಗಿ ಇವನ್ನು ಉತ್ಪಾದಿಸುವುದಿಲ್ಲ (ಉದಾಹರಣೆಗೆ ಹೈಡ್ರೊಕ್ಸಿಪ್ರೊಲಿನ್ ಮತ್ತು ಸೆಲೆನೊಮಿಥಿಯೊನಿನ್).
ಪ್ರೋಟೀನ್ನಲ್ಲಿ ಕಂಡುಬರುವ ಪ್ರೋಟೀನೊಜನಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಅನುವಾದ ನಂತರ ಮಾರ್ಪಾಡಿನಲ್ಲಿ ಸೇರಿಸಲಾಗುತ್ತದೆ. ಇದು ಪ್ರೋಟೀನ್ ಸಂಯೋಜನೆಯಲ್ಲಿ ಅನುವಾದದ ನಂತರ ಆಗುತ್ತದೆ. ಈ ಅನುವಾದದ ನಂತರದ ಬದಲಾವಣೆಗಳು ಪ್ರೋಟೀನ್ ಕಾರ್ಯನಿರ್ವಹಣೆಗೆ ಮತ್ತು ನಿಯಂತ್ರಣಕ್ಕೆ ಅಗತ್ಯ. ಉದಾಹರಣೆಗೆ ಗ್ಲುಟಾಮೇಟ್ನ ಕಾರ್ಬೋಕ್ಸಿಲಾಗಿಸುವಿಕೆಯು (-COOH ಸೇರಿಸುವುದು) ಕ್ಯಾಲಿಸಿಯಂನ ಧನ ಅಯಾನು ಚೆನ್ನಾಗಿ ಬಂಧಿಸಲು ಅವಕಾಶ ಮಾಡಿಕೊಡುತ್ತದೆ[೩೮] ಮತ್ತು ಪ್ರೊಲಿನ್ನ ಹೈಡ್ರೋಕ್ಸಿಲಾಗಿಸುವುದು (-OH ಸೇರಿಸುವುದು) ಸಂಯೋಜಕ ಅಂಗಾಂಶ ಪೋಷಣೆಯಲ್ಲಿ ಪ್ರಮುಖ ಪಾತ್ರವಹಿಸುತ್ತದೆ.[೩೯] ಇನ್ನೊಂದು ಉದಾಹರಣೆ ಲೈಸಿನ್ನ ಉಳಿಕೆ ಮಾರ್ಪಾಡಿನ ಮೂಲಕ ಅನುವಾದ ಆರಂಭ ಏಜೆಂಟು EIF5Aನಲ್ಲಿ ಹೈಪುಸಿನ್ ತಯಾರಾಗುವುದು.[೪೦] ಇಂತಹ ಮಾರ್ಪಾಡುಗಳು ಪ್ರೋಟೀನ್ನ ಸ್ಥಳೀಯವಾಗುವುದನ್ನು ನಿರ್ಣಯಿಸುತ್ತವೆ. ಉದಾಹಣೆಗೆ ಪ್ರೋಟೀನ್ಗೆ ದೊಡ್ಡ ಹೈಡ್ರೋಫೋಬಿಕ್ (ನೀರನ್ನು ವಿಕರ್ಷಿಸುವ) ಗುಂಪನ್ನು ಸೇರಿಸುವುದು ಅದನ್ನು ಫಾಸ್ಪೊಲಿಪಿಡ್ ಪೊರೆಗೆ ಬಂಧಿತವಾಗುವಂತೆ ಮಾಡುತ್ತದೆ.[೪೧]
ಕೆಲವು ಪ್ರೋಟೀನ್ಜನಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು ಪ್ರೋಟೀನ್ಗಳಲ್ಲಿ ಕಂಡುಬರುವುದಿಲ್ಲ. ಉದಾಹರಣೆಗಳಲ್ಲಿ ಲ್ಯಾಂಥಿಯೊನಿನ್, ೨-ಅಮಿನೊಐಸೋಬುಟೈರಿಕ್ ಆಮ್ಲ, ಡಿಹೈಡ್ರೋಅಲೆನಿನ್ ಮತ್ತು ನರಪ್ರೇಕ್ಷಕ[ಟಿಪ್ಪಣಿ ೩] ಗಾಮ-ಅಮಿನೊಬುಟೈರಿಕ್ ಆಮ್ಲಗಳು ಸೇರಿವೆ. ಪ್ರೋಟೀನ್ಜನಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು ಕೆಲವೊಮ್ಮೆ ಪ್ರಮಾಣಕ ಅಮಿನೊ ಆಮ್ಲಗಳ ಚಯಾಪಚಯದ ಪ್ರತಿಕ್ರಿಯಾ ಸರಣಿಯಲ್ಲಿ ಮಧ್ಯವರ್ತಿಗಳಾಗಿ ಬರುತ್ತವೆ. ಉದಾಹರಣೆಗೆ ಆರ್ನಿಥಿನ್ ಮತ್ತು ಸಿಟ್ರುಲಿನ್ಗಳು ಅಮಿನೊ ಆಮ್ಲಗಳ ಕೆಟಾಬಲಿಸಂ ಭಾಗವಾದ ಯೂರಿಯ ಚಕ್ರದಲ್ಲಿ ಕಂಡುಬರುತ್ತವೆ.[೪೨] ಜೀವಶಾಸ್ತ್ರದಲ್ಲಿ α-ಅಮಿನೊ ಆಮ್ಲಗಳ ಪ್ರಾಬಲ್ಯದ ನಡುವೆ ವಿರಳ ಅಪವಾದ β ಅಮಿನೊ ಆಮ್ಲ ಬೀಟಾ ಅಲೆನಿನ್ (೩-ಅಮಿನೊಪ್ರೊಪಾನೊಯಿಕ್ ಆಮ್ಲ) ಮತ್ತು ಇದನ್ನು ಸಸ್ಯಗಳು ಮತ್ತು ಸೂಕ್ಷ್ಮಜೀವಿಗಳು ಸಹಕಿಣ್ವ ಎಯ ಭಾಗವಾದ ಪ್ಯಾಂಟೊಥೆನಿಕ್ ಆಮ್ಲದ (ವಿಟಾಮಿನ್ B5) ತಯಾರಿಕೆಯಲ್ಲಿ ಬಳಸುತ್ತವೆ.[೪೩]
ನಿಸರ್ಗದಲ್ಲಿ ಡಿ-ಅಮಿನೊ ಆಮ್ಲಗಳ ಅಧಿಕ್ಯತೆ
[ಬದಲಾಯಿಸಿ]ಇತ್ತೀಚಿಗೆ ಮುಖ್ಯವಾಗಿ ಒಂದು ಸೋಸುವ ಕಾಗದದ (ಫಿಲ್ಟರ್ ಪೇಪರ್) ಮೇಲೆ ಬೇರೆ ಬೇರೆ ಅಮೈನೋ ಆಮ್ಲಗಳನ್ನು ಬೇರ್ಪಡಿಸುವ ಕಾಗದದ ವರ್ಣಮಾಪನ ವಿಧಾನವೆಂಬ (ಪೇಪರ್ ಕ್ರೊಮೊಟೋಗ್ರಫಿ) ಪ್ರಬಲ ಸಾಧನ ಬಳಕೆಗೆ ಬಂದ ಮೇಲೆ ಅಮೈನೋ ಆಮ್ಲಗಳ ಒಂದು ಪಡೆಯೇ ಗೊತ್ತಾಗಿದೆ. ಇಲ್ಲಿನ ತನಕ ೧೮೦ಕ್ಕೂ ಮೀರಿದಷ್ಟು ಅಮೈನೋ ಆಮ್ಲಗಳು ತಿಳಿದಿವೆ. ಇವುಗಳಲ್ಲಿ ಈ ಹೊಸ ಅಮೈನೋ ಆಮ್ಲಗಳು ಬಹುಪಾಲು ಗಿಡಮರಗಳಲ್ಲಿ ಸೂಕ್ಷ್ಮಜೀವಾಣುಗಳಂಥ ಕೆಳದರ್ಜೆಯ ಜೀವಿಗಳಲ್ಲೂ ಕಂಡುಬಂದಿವೆ. ಇವುಗಳಲ್ಲಿ ಎಲ್ಲವೂ ಎಡಮುರಿಯವಲ್ಲ. ಜೀವಿರೋಧಕಗಳು (ಅ್ಯಂಟಿಬಯೋಟಿಕ್ಸ್) ವಿಷಗಳಂಥ ಮದ್ದಾಗಿ ವರ್ತಿಸುವ ಅನೇಕ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಬಲಮುರಿಯ ಅಮೈನೋ ಆಮ್ಲಗಳೂ ನಿಸರ್ಗದಲ್ಲಿ ಎಷ್ಟೋ ಇವೆ. ಕೆಲವು ದಂಡಾಣುಜೀವಿಗಳ (ಬ್ಯಾಸಿಲ್ಲಸ್ ಸಬ್ಟೆಲಿಸ್) ಕಣಗೋಡೆಯಲ್ಲಿ ಇವಿವೆ. ನಿಸರ್ಗದಲ್ಲಿ ಬಿಡಿಯಾಗಿ ಸಿಗುವ ಅಮೈನೋ ಆಮ್ಲಗಳು ಹೇರಳವಾಗಿದ್ದರೂ (೧೯೩೫)ರಲ್ಲಿ ತ್ರಿಯೊನೀನನ್ನು ಕಂಡುಹಿಡಿದಾಗಿಂದ ಪ್ರೊಟೀನುಗಳಲ್ಲಿನ ಅಮೈನೋ ಆಮ್ಲಗಳು ಮಾತ್ರ ಸುಮಾರು (೨೦)ಕ್ಕೆ ಮೀರಿಲ್ಲ. ಜೀವವಸ್ತು ಕರಣದ ನಿಜಗೆಲಸಗಳಲ್ಲಿ (ಮೆಟಬಾಲಿಕ್ ಫಂಕ್ಷನ್ಸ್) ಹೊಸದಾಗಿ ಕಂಡುಬಂದ ಈ ಅಮೈನೋ ಆಮ್ಲಗಳ ಪಾತ್ರ ಏನೇನೂ ತಿಳಿದಿಲ್ಲ.
ಡಿ-ಸಮಾಂಗಿಗಳು ಬದುಕಿರುವ ಜೀವಿಗಳಲ್ಲಿ ಸಾಮಾನ್ಯವಲ್ಲ. ಉದಾಹರಣೆಗೆ ಗ್ರಾಮಿಸಿಡಿನ್ ಪಾಲಿಪೆಪ್ಟೈಡ್ ಡಿ- ಮತ್ತು ಎಲ್- ಅಮಿನೊ ಆಮ್ಲಗಳ ಮಿಶ್ರಣ.[೪೪] ಡಿ-ಅಮಿನೊ ಆಮ್ಲಗಳು ಕಂಡುಬರುವ ಸಂಯುಕ್ತಗಳೆಂದರೆ ಟೈರೊಸಿಡಿನ್ ಮತ್ತು ವಲಿನೊಮೈಸಿನ್. ಈ ಸಂಯುಕ್ತಗಳು ಬ್ಯಾಕ್ಟೀರಿಯದ, ವಿಶೇಷವಾಗಿ ಗ್ರಾಮ್-ಪಾಸಿಟಿವ್ ಬ್ಯಾಕ್ಟೀರಿಯದ ಕೋಶಪೊರೆಯನ್ನು ಛಿದ್ರಗೊಳಿಸುತ್ತವೆ. ಸ್ವಿಸ್-ಪ್ರೊಟ್ ದತ್ತಾಂಶ ಸಂಗ್ರಹದಲ್ಲಿ ಕೇವಲ ೮೩೭ ಡಿ-ಅಮಿನೊ ಆಮ್ಲಗಳು ಮಾತ್ರ ಇವೆ. (೧೮೭ ದಶಲಕ್ಷ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ವಿಶ್ಲೇಷಿಸಲಾಗಿದೆ.)[೪೫]
ಪ್ರಮಾಣಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು
[ಬದಲಾಯಿಸಿ]ಇಪತ್ತು ಅಮಿನೊ ಆಮ್ಲಗಳು ನೇರವಾಗಿ ಸಾರ್ವತ್ರಿಕ ಜೆನೆಟಿಕ್ ಕೋಡ್ನಲ್ಲಿ ಕೋಡಾನುಗಳ ಮೂಲಕ ಸಂಕೇತಿಸಲ್ಪಟ್ಟಿವೆ ಮತ್ತು ಇವನ್ನು ಪ್ರಮಾಣಕ ಅಥವಾ ಅಧಿಕೃತ ಅಮಿನೊ ಆಮ್ಲಗಳೆಂದು ಕರೆಯಲಾಗಿದೆ. ಇತರ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಪ್ರಮಾಣಕಗಳಲ್ಲದ ಅಥವಾ ಅನಧಿಕೃತ ಅಮಿನೊ ಆಮ್ಲಗಳು. ಬಹಳಷ್ಟು ಪ್ರಮಾಣಕಗಳಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು ಪ್ರೋಟೀನೊಜನಕಗಳಲ್ಲ (ಅವನ್ನು ಪ್ರೋಟೀನ್ ಸಂಯೋಜನೆಯಲ್ಲಿ ಬಳಸುವುದಿಲ್ಲ). ಆದರೆ ಇವುಗಳಲ್ಲಿ ಮೂರು ಪ್ರೋಟಿನೊಜನಕಗಳು ಮತ್ತು ಇವನ್ನು ಸಾರ್ವತ್ರಿಕ ಜೆನೆಟಿಕ್ ಕೋಡ್ಗಳಲ್ಲಿ ಇಲ್ಲದ ಮಾಹಿತಿಯನ್ನು ಉಪಯೋಗಿಸಿ ಪ್ರೋಟೀನ್ ರಚನೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ.
ಮಾನವನ ಪೋಷಕಾಂಶಗಳಾಗಿ
[ಬದಲಾಯಿಸಿ]ಆಹಾರದ ಭಾಗವಾಗಿ ೨೦ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಸೇವಿಸಿದಾಗ ಅವುಗಳನ್ನು ಪ್ರೋಟೀನ್ ಸಂಯೋಜನೆಗೆ ಬಳಸಲಾಗುತ್ತದೆ ಅಥವಾ ಅವುಗಳಿಗೆ ಆಕ್ಸಿಡೇಶನ್ ಅಥವಾ ಆಮ್ಲಜನಕ ಸೇರ್ಪಡೆಯಾಗಿ ಯೂರಿಯ ಮತ್ತು ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಆಗಿ ಶಕ್ತಿಯ ಮೂಲವಾಗುತ್ತವೆ.[೪೬] ಆಕ್ಸಿಡೇಶನ್ ಪ್ರತಿಕ್ರಿಯಾ ಸರಣಿಯು ಟ್ರಾನ್ಸ್ಅಮಿನೇಸ್[ಟಿಪ್ಪಣಿ ೧೩] ಎನ್ನುವ ಕಿಣ್ವವು ಅಮಿನೊ ಗುಂಪನ್ನು ತೆಗೆಯುವದರೊಂದಿಗೆ ಆರಂಭವಾಗುತ್ತದೆ ಮತ್ತು ಅಮಿನೊ ಗುಂಪನ್ನು ಯೂರಿಯ ಚಕ್ರಕ್ಕೆ[ಟಿಪ್ಪಣಿ ೧೪] ಸೇರಿಸುತ್ತದೆ. ಟ್ರಾನ್ಸ್ಅಮಿಡೇಶನ್ನ ಇತರ ಉತ್ಪಾದನೆಗಳು ಸಿಟ್ರಿಕ್ ಆಮ್ಲದ ಚಕ್ರಕ್ಕೆ[ಟಿಪ್ಪಣಿ ೧೫] ಸೇರುವ ಕೆಟೊ ಆಮ್ಲ.[೪೭] ಗ್ಲುಕೊಜನಕ ಅಮಿನೊ ಆಮ್ಲಗಳು ಗ್ಲುಕೊಜೆನೆಸಿಸ್ ಮೂಲಕ ಗ್ಲುಕೊಸ್ ಆಗಿ ಪರಿವರ್ತಿತವಾಗುತ್ತವೆ.[೪೮] ೨೦ ಅಮಿನೊ ಆಮ್ಲಗಳಲ್ಲಿ ಒಂಬತ್ತು (ಹೆಚ್ಐಎಸ್, ಐಎಲ್ಇ, ಎಲ್ಇಯು, ಎಲ್ವೈಎಸ್, ಎಂಇಟಿ, ಪಿಹೆಚ್ಇ, ಟಿಹೆಚ್ಅರ್, ಟಿಆರ್ಪಿ ಮತ್ತು ವಿಎಎಲ್- ಅಮಿನೊ ಆಮ್ಲಗಳ ಹೆಸರಿನ ಈ ಸಣ್ಣ ರೂಪಕ್ಕೆ ಕೆಳಗಿನ ಕೋಷ್ಟಕ ನೋಡಿ) ಅಗತ್ಯ ಅಮಿನೊ ಆಮ್ಲಗಳೆಂದು ಹೆಸರಿಸಲಾಗಿದೆ. ಏಕೆಂದರೆ ಇವುಗಳನ್ನು ಮಾನವ ದೇಹವು ಇತರ ಸಂಯುಕ್ತಗಳನ್ನು ಬಳಸಿ ಸಾಮಾನ್ಯ ಬೆಳವಣಿಗೆ ಅಗತ್ಯವಾದಷ್ಟು ಉತ್ಪಾದಿಸಲಾರದು. ಹೀಗಾಗಿ ಇವನ್ನು ಆಹಾರದ ಮೂಲಕವೇ ತೆಗೆದುಕೊಳ್ಳಬೇಕು.[೪೯][೫೦][೫೧] ಇವಲ್ಲದೆ ಮಕ್ಕಳಿಗೆ ಸಿಸ್ಟೇಯಿನ್, ಟಾಯುರಿನ್, ಟೈರೊಸಿನ್ ಮತ್ತು ಆರ್ಗಿನಿನ್ಗಳು ಅರೆ-ಅಗತ್ಯದ ಅಮಿನೊ ಆಮ್ಲಗಳು (ತಾಂತ್ರಿಕ ಅರ್ಥದಲ್ಲಿ ಟಾಯುರಿನ್ ಅಮಿನೊ ಆಮ್ಲವಲ್ಲ) ಏಕೆಂದರೆ ಅವರಲ್ಲಿ ಚಯಾಪಚಯ ಪ್ರತಿಕ್ರಿಯಾ ಸರಣಿಗಳು ಈ ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಸಂಯೋಜಿಸಲು ಪೂರ್ಣವಾಗಿ ಅಭಿವೃದ್ಧಿಯಾಗಿರುವುದಿಲ್ಲ.[೫೨][೫೩] ಅಮಿನೊ ಆಮ್ಲಗಳು ಎಷ್ಟು ಪ್ರಮಾಣದಲ್ಲಿ ಬೇಕು ಎನ್ನುವುದು ವ್ಯಕ್ತಿಯ ವಯಸ್ಸು ಮತ್ತು ಆರೋಗ್ಯದ ಮೇಲೆ ಆಧಾರಪಟ್ಟಿರುತ್ತದೆ. ಹೀಗಾಗಿ ಕೆಲವೊಂದು ಅಮಿನೊ ಆಮ್ಲಗಳು ಆಹಾರದಲ್ಲಿ ಇಷ್ಟೇ ಪ್ರಮಾಣದಲ್ಲಿ ಇರಬೇಕು ಎಂದು ಸಾಮಾನ್ಯ ಹೇಳಿಕೆ ನೀಡುವುದು ಕಷ್ಟದ ಕೆಲಸ.
ಪ್ರೋಟೀನೇತರ ಕಾರ್ಯಗಳು
[ಬದಲಾಯಿಸಿ]ಮಾನವನಲ್ಲಿನ ಪ್ರೋಟೀನ್ಗಳಾಗದ ಅಮಿನೊ ಆಮ್ಲಗಳಿಗೆ ಚಯಾಪಚಯದ ಮಧ್ಯವರ್ತಿಗಳಂತಹ ಮಹತ್ವದ ಪಾತ್ರಗಳಿವೆ. ಇಂತಹದರಲ್ಲಿ ಒಂದು ನರಪ್ರೇಕ್ಷಕ ಗಾಮ-ಅಮಿನೊ-ಬುಟೈರಿಕ್ ಆಮ್ಲ (ಜಿಎಬಿಎ) ಜೈವಿಕ ಸಂಯೋಜನೆ. ಹಲವು ಅಮಿನೊ ಆಮ್ಲಗಳನ್ನು ಇತರ ಅಣುಗಳ ಸಂಯೋಜನೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಉದಾರಣೆಗೆ ಟ್ರಿಪ್ಟೋಫಾನ್ ನರಪ್ರೇಕ್ಷಕ ಸೆರೊಟೊನಿನ್ನ ಪೂರ್ವವರ್ತಿ (ಪ್ರಿಕರ್ಸರ್).[೫೪] ಹೀಗೆ ಪಟ್ಟಿಯನ್ನು ಬೆಳಸ ಬಹುದು. ಇತರ ಹಲವು ಹೇರಳವಾಗಿರುವ ಪ್ರಮಾಣಿಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು ಮಾಡುವ ಎಲ್ಲಾ ಕೆಲಸಗಳು ತಿಳಿದಿಲ್ಲ.
ಕೆಲವು ಪ್ರಮಾಣಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು ಸಸ್ಯಗಳಲ್ಲಿ ಸಸ್ಯಹಾರಿಗಳಿಂದ ರಕ್ಷಿಸಿಲು ಬಳಸಲ್ಪಡುತ್ತವೆ.[೫೫] ಉದಾಹರಣೆಗೆ ಆರ್ಗಿನಿನ್ನ್ನು ಹೋಲುವ ಕ್ಯಾನವನೈನಿ ಹಲವು ದ್ವಿದಳಧಾನ್ಯದ ಸಸ್ಯಗಳಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ[೫೬] ಮತ್ತು ದೊಡ್ಡ ಪ್ರಮಾಣದಲ್ಲಿ ಕ್ಯಾನವಲಿಯ ಗ್ಲಾಡಿಯಾಟದಲ್ಲಿ ಕಂಡುಬರುತ್ತದೆ.[೫೭] ಈ ಅಮಿನೊ ಆಮ್ಲ ಕೀಟಗಳಂತಹ ಪರಭಕ್ಷಗಳಿಂದ ರಕ್ಷಿಸುತ್ತದೆ ಮತ್ತು ಮಾನವರು ಇದನ್ನು ಆಹಾರವಾಗಿ ಸಂಸ್ಕರಿಸದೆ ಸೇವಿಸಿದಾಗ ಅಸ್ವಸ್ಥರಾಗುತ್ತಾರೆ.[೫೮]
ಕೈಗಾರಿಕೆಯಲ್ಲಿ ಬಳಕೆ
[ಬದಲಾಯಿಸಿ]ಅಮಿನೊ ಆಮ್ಲಗಳಿಗೆ ಕೈಗಾರಿಕೆಯಲ್ಲಿ ಹಲವು ರೀತಿಯಲ್ಲಿ ಉಪಯೋಗಗಳಿವೆಯಾದರೂ ಪ್ರಮುಖ ಉಪಯೋಗವು ಪ್ರಾಣಿಗಳ ಆಹಾರದಲ್ಲಿ ಸೇರಿಸುವುದಾಗಿದೆ. ಇದರ ಅಗತ್ಯವಾಗುವುದು ಆಹಾರದಲ್ಲಿ ದೊಡ್ಡ ಪ್ರಮಾಣದಲ್ಲಿ ಸೇರಿಸುವ ಸೋಯಾಬೀನ್ಗಳಂತವುಗಳಲ್ಲಿ ಕೆಲವು ಅಗತ್ಯ ಅಮಿನೊ ಆಮ್ಲಗಳು ಸಣ್ಣ ಪ್ರಮಾಣದಲ್ಲಿವೆ ಅಥವಾ ಇಲ್ಲವೇ ಇಲ್ಲ ಎನ್ನುವ ಕಾರಣಕ್ಕೆ. ಉದಾಹರಣೆಗೆ ಲೈಸಿನ್, ಮೆಥಿಯೊನಿನ್, ಥ್ರೆಯೊನಿನ್ ಮತ್ತು ಟ್ರಿಪ್ಟೊಫಾನ್ಗಳು. ಇವು ಆಹಾರ ಉತ್ಪಾದನೆಯಲ್ಲಿ ಬಹಳ ಮಹತ್ವ ಪಡೆದಿವೆ.[೫೯] ಪೂರಕಗಳು ಲೋಹ ಧನಾವೇಶವನ್ನು ಕೊಂಡಿಯಂತೆ ಹಿಡಿದಿಕೊಳ್ಳುವ ಮೂಲಕ ಖನಿಜ ಹೀರಿಕೊಳ್ಳುವಿಕೆಯನ್ನು ಉತ್ತಮಗೊಳಿಸುವ ಕೆಲಸವನ್ನು ಅಮಿನೊ ಆಮ್ಲಗಳು ಮಾಡುತ್ತವೆ. ಈ ಖನಿಜಗಳು ಪ್ರಾಣಿಗಳ ಉತ್ಪಾದನೆ ಅಥವಾ ಅವುಗಳ ಆರೋಗ್ಯ ಸುಧಾರಿಸಲು ಅಗತ್ಯ.[೬೦]
ಆಹಾರ ಕೈಗಾರಿಕೆಯು ಅಮಿನೊ ಆಮ್ಲದ ವಿಶೇಷವಾಗಿ ಪರಿಮಳ ಹೆಚ್ಚಿಸುವ ಗ್ಲುಟಮಿಕ್ ಆಮ್ಲ[೬೧] ಮತ್ತು ಕಡಿಮೆ ಕ್ಯಾಲರಿಗಳಿರುವ ಕೃತಕ ಸಿಹಿಯಾಗಿಸುವ ಪದಾರ್ಥವಾದ ಆಸ್ಪರ್ಟೇಮ್ಗಳ (ಆಸ್ಪರ್ಟೈಲ್-ಫೆನೈಲಲನಿನ್-೧-ಮಿಥೈಲ್ ಇಸ್ಟರ್)[೬೨] ದೊಡ್ಡ ಗ್ರಾಹಕ. ಇಲ್ಲಿಯೂ ಸಹ ಪ್ರಾಣಿಗಳ ಪೋಷಕಾಂಶದಂತಹ ತಂತ್ರಜ್ಞಾನವನ್ನೇ ಬಳಸಲಾಗುತ್ತದೆ. ಮಾನವನ ಪೋಷಕಾಂಶ ಕೈಗಾರಿಕೆ ಖನಿಜ ಹೀರಿಕೊಳ್ಳುವಿಕೆ ಸುಧಾರಿಸಲು ಮತ್ತು ಸಾವಯವಗಳಲ್ಲದ ಖನಿಜಗಳ ಕೆಟ್ಟ ಅನುಷಂಗಿಕ ಪರಿಣಾಮಗಳನ್ನು ಕಡಿಮೆ ಮಾಡಲು ಇದನ್ನು ಬಳಸುವ ಮೂಲಕ ಅನಿಮಿಯ ಅಥವಾ ರಕ್ತಹೀನತೆಗಳಂತಹ ಖನಿಜಗಳ ಕೊರತೆಯ ಲಕ್ಷಣಗಳನ್ನು ಉಪಶಮನ ಮಾಡುತ್ತದೆ.[೬೩] ಅಮಿನೊ ಆಮ್ಲಗಳ ಕೊಂಡಿಯಂತೆ ಹಿಡಿದುಕೊಳ್ಳುವ ಶಕ್ತಿಯನ್ನು ಕೃಷಿ ಗೊಬ್ಬರ ತಯಾರಿಕೆಯಲ್ಲೂ ಬಳಸಲಾಗುತ್ತದೆ. ಖನಿಜಗಳನ್ನು ಸಸ್ಯಗಳಿಗೆ ರವಾನಿಸುವ ಮೂಲಕ ಕಬ್ಬಿಣ ಬಿಳಿಚುವಿಕೆಯಂತಹ (ಕ್ಲೊರೋಸಿಸ್) ಖನಿಜ ಕೊರತೆಯನ್ನು ಸರಿಪಡಿಸಲು ಇದನ್ನು ಬಳಸಲಾಗುತ್ತದೆ. ಈ ಗೊಬ್ಬರಗಳನ್ನು ಕೊರತೆಗಳು ಬರದಂತೆ ಮಾಡಲು ಮತ್ತು ಸಸ್ಯಗಳ ಒಟ್ಟಾರೆ ಆರೋಗ್ಯ ಸುಧಾರಿಸಲು ಸಹ ಬಳಸಲಾಗುತ್ತದೆ.[೬೪] ಇತರ ಅಮಿನೊ ಆಮ್ಲಗಳ ಬಳಕೆ ಔಷಧಿಗಳು ಮತ್ತು ಸೌಂದರ್ಯವರ್ಧಕಗಳ ಸಂಯೋಜನೆಯಲ್ಲಿ ಇದೆ.[೩೩] ಹಾಗೆಯೇ ಕೆಲವು ಅಮಿನೊ ಆಮ್ಲಗಳ ನಿಷ್ಪನ್ನಗಳನ್ನು ಔಷಧಿ ಕೈಗಾರಿಕೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ. ಇವು ಪ್ರಾಯೋಗಿಕವಾಗಿ ಖಿನ್ನತೆಯ ಚಿಕಿತ್ಸೆಗೆ ಬಳಸುವ ೫-ಹೆಚ್ಟಿಪಿಯನ್ನು (೫-ಹೈಡ್ರೋಕ್ಸಿಟ್ರೈಟೊಫಾನ್),[೬೫] ಪಾರ್ಕಿನ್ಸನ್ ಕಾಯಿಲೆ ಚಿಕಿತ್ಸೆಗೆ ಬಳಸುವ ಎಲ್-ಡಿಒಪಿಎ (ಎಲ್-ಡಿಹೈಡ್ರೋಕ್ಸಿಫೆನೈಲಲನಿನ್)[೬೬] ಮತ್ತು ನಿದ್ರೆ ಕಾಯಿಲೆಯಲ್ಲಿ ಬಳಸುವ ಆರ್ನಿಥೈನ್ ಡಿಕಾರ್ಬೋಕ್ಸಿಲೇಸ್ಗೆ ತಡೆಯೊಡ್ಡುವ ಔಷದಿ ಎಫ್ಲೊರ್ನಿಥಿನ್ಗಳನ್ನು ಒಳಗೊಂಡಿವೆ.[೬೭]
ಜೈವಿಕವಾಗಿ ವಿಘಟಿನೀಯ ಪ್ಲಾಸ್ಟಿಕ್ಗಳು
[ಬದಲಾಯಿಸಿ]ಹೆಚ್ಚಿನ ಮಾಹಿತಿಗೆ ನೋಡಿ ಲೇಖನ ಜೈವಿಕ ವಿಘಟನೀಯ ಪ್ಲಾಸ್ಟಿಕ್
ಅಮಿನೊ ಆಮ್ಲಗಳು ಹಲವು ಜೈವಿಕವಾಗಿ ವಿಘಟನೀಯ ಪಾಲಿಮರ್ಗಳ ಭಾಗವಾಗುವದರ ಬಗೆಗೆ ಕೆಲವು ಬೆಳವಣಿಗೆಗಳಾಗಿವೆ. ಈ ಪದಾರ್ಥಗಳ ಅನ್ವಕತೆಯು ಪರಿಸರ ಸ್ನೇಹಿ ಪ್ಯಾಕಿಂಗ್ ಪದಾರ್ಥಗಳ ತಯಾರಿಕೆ ಮತ್ತು ವೈದ್ಯಕೀಯದಲ್ಲಿ ಔಷದ ಹಂಚಿಕೆ[ಟಿಪ್ಪಣಿ ೧೬] ಹಾಗೂ ದೇಹದಲ್ಲಿ ಕಾಣೆಯಾದ ಭಾಗದ ಕೃತಕ ರಚನೆಯಲ್ಲಿ ಇದೆ. ಈ ಪಾಲಿಮರ್ಗಳಲ್ಲಿ ಮುಖ್ಯ ಸರಪಳಿ ಅಥವಾ ಪಕ್ಕದ-ಸರಪಳಿಗಳು ಅಮಿನೊ ಆಮ್ಲಗಳಾಗಿರುವ ಪಾಲಿಪೆಪ್ಟೈಡ್, ಪಾಲಿಅಮೈಡ್, ಪಾಲಿಸ್ಟರ್, ಪಾಲಿಸಲ್ಫೈಡ್ ಮತ್ತು ಪಾಲಿಯುರೆಥೇನ್ಗಳು ಸೇರಿವೆ. ಈ ಮಾರ್ಪಾಡುಗಳು ಪಾಲಿಮರ್ಗಳ ಭೌತಿಕ ಗುಣಗಳನ್ನು ಮತ್ತು ಪ್ರತಿಕ್ರಿಯಿಸುವ ರೀತಿಯನ್ನು ಬದಲಾಯಿಸುತ್ತವೆ.[೬೮] ನೀರಲ್ಲಿ ಕರಗಬಲ್ಲ ಜೈವಿಕವಾಗಿ ವಿಘಟಿನೀಯ ಪಾಲಿಮರ್ ಪಾಲಿಅಸ್ಪರ್ಟೇಟ್ ಇದಕ್ಕೊಂದು ಆಸಕ್ತಿದಾಯಕ ಉದಾಹರಣೆ. ಬಿಸಟು ಬಹುದಾದ ಡಯಾಪರ್ಗಳ[ಟಿಪ್ಪಣಿ ೧೭] ತಯಾರಿಕೆ ಮತ್ತು ಕೃಷಿಯಲ್ಲಿ ಇದನ್ನು ಬಳಸಬಹುದು.[೬೯] ಪಾಲಿಅಸ್ಪರ್ಟೇಟ್ ಕರಗುವಿಕೆ ಮತ್ತು ಲೋಹ ಆಯಾನುಗಳೊಂದಿಗೆ[ಟಿಪ್ಪಣಿ ೧೮] ಬಂಧಿತವಾಗುವ ಹಿನ್ನೆಲೆಯಲ್ಲಿ ಅವುಗಳನ್ನು ವಿಘಟಿನೀಯ ಸ್ಕೇಲಿಂಗ್[ಟಿಪ್ಪಣಿ ೧೯] ವಿರೋಧಿ ಏಜೆಂಟಾಗಿ ಮತ್ತು ಸವೆತ ನಿಷೇದಕಗಳ[ಟಿಪ್ಪಣಿ ೨೦] ತಯಾರಿಕೆಯಲ್ಲಿ ಬಳಸಲಾಗುತ್ತದೆ.[೭೦][೭೧] ಜೊತೆಗೆ ಟೈರೊಸಿನ್ ಅಮಿನೊ ಆಮ್ಲವನ್ನು ಪಾಲಿಕಾರ್ಬನೇಟ್ಗಳ ತಯಾರಿಕೆಯಲ್ಲಿ ಬಿಸ್ಫೆನಾಲ್ಗಳಂತಹ ವಿಷಪೂರಿ ಫೆನಾಲ್ಗಳ ಬದಲಿಗೆ ಬಳಸುವ ಸಾಧ್ಯತೆ ಇದೆ.[೭೨]
ರಾಸಾಯನಿಕ ಕ್ರಿಯೆಗಳು
[ಬದಲಾಯಿಸಿ]ಎಲ್ಲ ಅಮೈನೋ ಆಮ್ಲಗಳ ರಾಸಾಯನಿಕ ರಚನೆಯೂ ಒಂದೇ ಬಗೆಯಲ್ಲಿ ಇರುವುದರಿಂದ, ಇವುಗಳ ಜೀವರಾಸಾಯನಿಕ ವರ್ತನೆಗಳೂ ಬಹುಮಟ್ಟಿಗೆ ಒಂದೇ ತೆರ. ಈ ವರ್ತನೆಗಳನ್ನು ಪ್ರೊಟೀನ್ ಗುಣದ ಜೀವರಾಸಾಯನಿಕ ವೇಗವರ್ಧಕಗಳಾದ (ಕೆಟಾಲಿಸ್ಟ್ಸ್) ಕಿಣ್ವಗಳು (ಎನ್ಝೈಮ್ಸ್) ವೇಗವರ್ಧಿಸುತ್ತವೆ. ಅಮೈನೋ ಆಮ್ಲಗಳ ಚಯಾಪಚಯದ ಹಲವಾರು ಕಿಣ್ವಗಳ ಚಟುವಟಿಕೆಗೆ ಫ಼್ಯಾಕ್ಟರ್ ಇಲ್ಲವೆ ಸಹಕಿಣ್ವವಾದ ಪಿರಿಡಾಕ್ಸಾಲ್ ಫಾಸ್ಫೇಟು ಬೇಕು. ಈ ಕೂಡಂಶ B6 ಜೀವಾತುವಿಂದ ಹುಟ್ಟುತ್ತದೆ. B6 ಜೀವಾತಿನ ಕೊರತೆ ದೇಹದಲ್ಲಿ ಉಂಟಾದರೆ ಅಮೈನೋ ಆಮ್ಲಗಳ ಚಯಾಪಚಯ ಕೆಡುವುದು. ಕರುಳಿನಿಂದ ಆಹಾರದ ರಕ್ತಗತವಾಗುವ ಮುಖ್ಯ ಕೆಲಸವೂ ಕೆಡಬಹುದು. ಅಮೈನೋ ಆಮ್ಲಗಳನ್ನು ಒಡೆಕೆಡುವುವ ಚಯಾಪಚಯಕ್ಕೆ (ಡಿಗ್ರೆಡೇಟಿವ್ ಮೆಟಬಾಲಿಸಂ) ಮುಖ್ಯವಾಗಿ ಎರಡು ದಾರಿಗಳಿವೆ. ಮೊದಲನೆಯ ದಾರಿಯಲ್ಲಿ ಅಮೈನೋ ಗುಂಪಿನ ಬೇರ್ಪಡೆಯಾಗಿ (C-C ಸೀಳಿಕೆ), ಇದು ಒಂದು ಇಂಗಾಲ ಶ್ರೇಣಿಯಾಗಿ ಪರಿವರ್ತನೆ ಹೊಂದಿ ಈ ಶ್ರೇಣಿ ಕೊಬ್ಬು, ಕಾರ್ಬೋಹೈಡ್ರೇಟುಗಳ ಎರಡರ ಚಯಾಪಚಯಕ್ಕೂ ಸಾಮಾನ್ಯವಾಗಿರುವ ಉತ್ಪನ್ನಗಳಾಗಿ ಬದಲಾಗುವ ಇಂಗಾಲ ಶ್ರೇಣಿಯಾಗುತ್ತದೆ. ಅಮೈನೋ ಗುಂಪಿನ ಸಾರಜನಕ ಕೊನೆಗೆ ಯೂರಿಯ, ಯೂರಿಕ್ ಆಮ್ಲ, ಅಮೋನಿಯಗಳಲ್ಲಿ ಕಾಣಿಸಿಕೊಳ್ಳುವುದು. ಪ್ರಮಾಣದಲ್ಲಿ ಎರಡನೆಯದಾರಿ ಅಷ್ಟು ಮುಖ್ಯವಲ್ಲ. ಇದರಲ್ಲಿ ಕಾರ್ಬಾಕ್ಸಿಲ್ ಗುಂಪಿನ ಬೇರ್ಪಡೆಯಾಗಿ (ಸಿ-ಸಿ ಸೀಳಿಕೆ) ಬರುವ ಅಮೀನುಗಳು ಬಲವಾದ ಅಂಕೆಲಸದ (ಫಿಸಿಯಲಾಜಿಕಲ್) ಪರಿಣಾಮಗಳನ್ನು ತೋರುತ್ತವೆ. ಆಮ್ಲಜನಕಗೂಡಿ ಈ ಅಮೀನುಗಳು ಆಯಾ ಆಮ್ಲಗಳಾಗಿ ಮೈಯಿಂದ ಹೊರಬೀಳುತ್ತವೆ.
ಜೈವಿಕ ಸಂಯೋಜನೆ
[ಬದಲಾಯಿಸಿ]ಸಸ್ಯಗಳಲ್ಲಿ ಸಾರಜನಕವು ಮೊದಲು ಗ್ಲುಟಮೇಟ್ ರೂಪದಲ್ಲಿ ಸಾವಯವ ಸಂಯುಕ್ತಗಳಲ್ಲಿ ಮಿಳಿತಗೊಳ್ಳುತ್ತದೆ, ಇದು ಮೈಟೊಕಾಂಡ್ರಿಯನ್ನಲ್ಲಿ ಆಲ್ಫಾ-ಕೆಟೊಗ್ಲುಟರೇಟ್ ಮತ್ತು ಅಮೊನಿಯಗಳಿಂದ ಆಗುತ್ತದೆ. ಇತರ ಅಮಿನೊ ಆಮ್ಲಗಳು ತಯಾರು ಮಾಡಲು ಸಸ್ಯಗಳು ಟ್ರಾನ್ಸ್ಅಮಿನೇಸ್ಗಳನ್ನು[ಟಿಪ್ಪಣಿ ೧೩] ಬಳಸಿ ಅಮಿನೊ ಗುಂಪನ್ನು ಇನ್ನೊಂದು ಆಲ್ಫಾ-ಕೆಟೊ ಕಾರ್ಬೋಲಿಕ್ ಆಮ್ಲಕ್ಕೆ ಸೇರಿಸುತ್ತದೆ. ಉದಾಹರಣೆಗೆ ಆಸ್ಪರ್ಟೇಟ್ ಅಮಿನೊಟ್ರಾನ್ಸ್ಫರೇಸ್ ಗ್ಲುಟಾಮೇಟ್ ಮತ್ತು ಆಕ್ಸಲೊಅಸಿಟೇಟ್ಗಳನ್ನು ಆಲ್ಫಾ-ಕೆಟೊಗ್ಲುಟರೇಟ್ ಮತ್ತು ಆಸ್ಪರ್ಟೇಟ್ ಆಗಿ ಪರಿವರ್ತಿಸುತ್ತದೆ.[೭೩] ಇತರ ಜೀವಿಗಳೂ ಅಮಿನೊ ಆಮ್ಲ ಸಂಯೋಜಿಸಲು ಟ್ರಾನ್ಸ್ಅಮಿನೇಸ್ಗಳನ್ನು ಬಳಸುತ್ತವೆ. ಪ್ರಮಾಣಕವಲ್ಲದ ಅಮಿನೊ ಆಮ್ಲಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಪ್ರಮಾಣಕ ಅಮಿನೊ ಆಮ್ಲಗಳ ಮಾರ್ಪಾಡಿನಿಂದ ಆಗುತ್ತವೆ. ಉದಾಹರಣೆಗೆ ಟ್ರಾನ್ಸ್ಸಲ್ಫರೇಶನ್ ಪ್ರತಿಕ್ರಿಯಾ ಸರಣಿ ಮೂಲಕವಾಗಲಿ ಅಥವಾ ಚಯಾಪಚಯ ಮಧ್ಯವರ್ತಿ ಎಸ್-ಅಡೆನೊಸಿಲ್ ಮೆಥಿಯೊನಿನ್ ಆಗಿ ನಂತರ ಮೆಥಿಯೊನಿನ್ನನಿಂದ ಮಿಥೈಲ್ ಗುಂಪು (CH3) ತೆಗೆಯಲ್ಪಡುವ ಮೂಲಕವಾಗಲಿ ಹೊಮೊಸಿಸ್ಟೇಯಿನ್ ರೂಪಗೊಳ್ಳುತ್ತದೆ.[೭೪] ಹೈಡ್ರೊಕ್ಸಿಪ್ರೊಲಿನ್ ಪ್ರೊಲಿನ್ನ ಅನುವಾದ ನಂತರದ ಮಾರ್ಪಾಟಿನಲ್ಲಿ ಆಗುತ್ತದೆ.[೭೫]
ಕೆಟಬಾಲಿಸಂ
[ಬದಲಾಯಿಸಿ]ಅಮಿನೊ ಆಮ್ಲಗಳ ಅಮೈನ್ ಮತ್ತು ಕಾರ್ಬೋಕ್ಸಿಲಿಕ್ ಆಮ್ಲ ಗುಂಪುಗಳು ಅಯಾನುಗಳಾಗ[ಟಿಪ್ಪಣಿ ೧೮] ಬಲ್ಲವು. ಹೀಗಾಗಿ ಅಮಿನೊ ಆಮ್ಲಗಳು ಮೊದಲು ಅಂಗಕಗಳು ಮತ್ತು ಜೀವಕೋಶಗಳಿಂದ ರಕ್ತಪರಿಚಲನೆಯನ್ನು ಪ್ರವೇಶಿಸುತ್ತವೆ. ಅಮಿನೊ ಆಮ್ಲದ ವಿಘಟನೆ ಲಿವರ್ ಮತ್ತು ಮೂತ್ರಪಿಂಡಗಳಲ್ಲಿ ನಡೆಯುತ್ತದೆ ಮತ್ತು ಕೆಲವು ಸಲ ಅಮಿನೊ[ಟಿಪ್ಪಣಿ ೧೦] ಗುಂಪನ್ನು ಆಲ್ಫಾ-ಕೆಟೊಗ್ಲುಟರೇಟ್ಗೆ ಸೇರಿಸಿ ಗ್ಲುಟಮೇಟ್ ಆಗುವುದನ್ನು ಒಳಗೊಳ್ಳುತ್ತದೆ. ಈ ಪ್ರಕ್ರಿಯೆ ಟ್ರಾನ್ಸ್ಅನಿನೇಸ್ಗಳನ್ನು ಒಳಗೊಳುತ್ತದೆ ಮತ್ತು ಹಲವು ಸಲ ಇವು ಸಂಯೋಜನೆಯ ಸಮಯದಲ್ಲಿ ಅಮಿನೊ ಗುಂಪನ್ನು ಸೇರಿಸುವವೇ ಆಗಿರುತ್ತವೆ. ಬಹಳಷ್ಟು ಕಶೇರುಕಗಳಲ್ಲಿ ಅಮಿನೊ ಗುಂಪು ತೆಗೆಯಲ್ಪಟ್ಟು ಯೂರಿಯ ಚಕ್ರಕ್ಕೆ ಹೋಗುತ್ತದೆ ಮತ್ತು ಯೂರಿಯಾ ಆಗಿ ವಿಸರ್ಜಿಸಲ್ಪಡುತ್ತದೆ. ಆದರೆ ಅಮಿನೊ ಆಮ್ಲದ ವಿಘಟನೆ ಯೂರಿಕ್ ಆಮ್ಲ ಅಥವಾ ಅಮೊನಿಯವನ್ನು ಉತ್ಪಾದಿಸಬಹುದು. ಉದಾಹರಣೆಗೆ ಸೆರಿನ್ ಡಿಹೈಡ್ರಟೇಸ್ ಸೆರಿನ್ನನ್ನು ಪೈರುವೇಟ್ ಮತ್ತು ಅಮೊನಿಯವಾಗಿ ಪರಿವರ್ತಿಸುತ್ತದೆ. [೭೬]ಅಮಿನೊ ಆಮ್ಲದ ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಅಮಿನೊ ಗುಂಪುಗಳು ತೆಗೆದ ಮೇಲೆ ಉಳಿದ ಅಣುವು ಹೊಸ ಅಮಿನೊ ಆಮ್ಲ ಸಂಯೋಜಿಸಲು ಬಳಕೆಯಾಗ ಬಹುದು ಅಥವಾ ಗೈಕೊಲೈಸಿಸ್ ಪ್ರವೇಶಿಸಿ ಶಕ್ತಿಯಾಗಿ ಬಳಕೆಯಾಗಬಹುದು ಅಥವಾ ಸಿಟ್ರಿಕ್ ಆಮ್ಲ ಚಕ್ರ ಪ್ರವೇಶಿಸಬಹದು.
| ಅಮಿನೊ ಆಮ್ಲ | ಮೂರು
ಅಕ್ಷರಗಳು [೭೭] |
ಒಂದು
ಅಕ್ಷರ [೭೭] |
ಪಕ್ಕದ-ಸರಪಳಿ
ದ್ರುವೀಯತೆ[೭೭] |
ಪಕ್ಕದ-ಸರಪಯಣಿಯ
ಆವೇಶ (ಪಿಹೆಚ್ ೭.೪) [೭೭] |
ಅಣುತೂಕ[೭೮] |
|---|---|---|---|---|---|
| ಅಲನಿನ್ | Ala | A | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೮೯.೦೯೪ |
| ಆರ್ಜಿನಿನ್ | Arg | R | ಪ್ರತ್ಯಾಮ್ಲ
ದ್ರುವೀಯತೆ |
ಧನ | ೧೭೪.೨೦೩ |
| ಅಸ್ಪರಜಿನ್ | Asn | N | ದ್ರುವೀಯತೆ | ತಟಸ್ಥ | ೧೩೨.೧೧೯ |
| ಆಸ್ಪರ್ಟಿಕ್ ಆಮ್ಲ | Asp | D | ಆಮ್ಲ
ದ್ರುವೀಯತೆ |
ಋಣ | ೧೩೩.೧೦೪ |
| ಸಿಸ್ಟೇಯಿನ್ | Cys | C | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೧೨೧.೧೫೪ |
| ಗ್ಲುಟಾಮಿಕ್ ಆಮ್ಲ | Glu | E | ಆಮ್ಲ
ದ್ರುವೀಯತೆ |
ಋಣ | ೧೪೭.೧೩೧ |
| ಗ್ಲುಟಮಿನ್ | Gln | Q | ದ್ರುವೀಯ | ತಟಸ್ಥ | ೧೪೬.೧೪೬ |
| ಗ್ಲೈಸಿನ್ | Gly | G | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೭೫.೦೬೭ |
| ಹಿಸ್ಟಿಡಿನ್ | His | H | ಪ್ರತ್ಯಾಮ್ಲ
ದ್ರುವೀಯತೆ |
ಧನ (೧೦%)
ಋಣ (೯೦%) |
೧೫೫.೧೫೬ |
| ಐಸೊಲುಸಿನ್ | Ile | I | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೧೩೧.೧೭೫ |
| ಲುಸಿನ್ | Leu | L | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೧೩೧.೧೭೫ |
| ಲೈಸಿನ್ | Lys | K | ಪ್ರತ್ಯಾಮ್ಲ | ಧನ | ೧೪೬.೧೮೯ |
| ಮಿಥಿಯೊನಿನ್ | Met | M | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೧೪೯.೨೦೮ |
| ಫೆನೈಲಲನಿನ್ | Phe | F | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೧೬೫.೧೯೨ |
| ಪ್ರೊಲಿನ್ | Pro | P | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೧೧೫.೧೩೨ |
| ಸೆರಿನ್ | Ser | S | ದ್ರುವೀಯ | ತಟಸ್ಥ | ೧೦೫.೦೯೩ |
| ಥ್ರೆಯೊನಿನ್ | Thr | T | ದ್ರುವೀಯ | ತಟಸ್ಥ | ೧೧೯.೧೨ |
| ಟ್ರಿಪ್ಟೊಫಾನ್ | Trp | W | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೨೦೪.೨೨೮ |
| ಟೈರೊಸಿನ್ | Tyr | Y | ದ್ರುವೀಯ | ತಟಸ್ಥ | ೧೮೧.೧೯೧ |
| ವಲಿನ್ | Val | V | ದ್ರುವೀಯವಲ್ಲ | ತಟಸ್ಥ | ೧೧೭.೧೪೮ |
| ಅಮಿನೊ ಆಮ್ಲ | ಮೂರು
ಅಕ್ಷರಗಳು |
ಒಂದು
ಅಕ್ಷರ |
ಅಣುತೂಕ |
|---|---|---|---|
| ಸೆಲೆನೊಸೆಸ್ಟೇಯಿನ್ | Sec | U | ೧೫೯.೦೬೫ |
| ಪೈರ್ರೋಲೈಸಿನ್ | Pyl | O | ೨೭೩.೩೨೫ |
ಟಿಪ್ಪಣಿಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ ಇಂಗ್ಲೀಶ್ ವಿಕಿಪೀಡಿಯದ Amino acid ಪುಟದ ಭಾಗಶಹ ಅನುವಾದ ಲಿಂಕ್ https://en.wikipedia.org/wiki/Amino_acid
- ↑ ಇವು ಗ್ರೀಕ್ನ ಅಕ್ಷರ ಮಾಲೆಯ ಆರಂಭಿಕ ಅಕ್ಷರಗಳು
- ↑ ೩.೦ ೩.೧ ೩.೨ ರಾಸಾಯನಿಕ ದೂತ ಎಂದು ಸಹ ಕರೆಯಲಾದ ಇವು ಸಂಕೇತಿಸುವ ಅಣುಗಳು. ಒಂದು ನರಕೋಶದಿಂದ ಬಿಡುಗಡೆಗೊಂಡ ಇವು ಇನ್ನೊಂದು ನರಕೋಶದ ರಿಸೆಪ್ಟಾರ್ಗಳು ಅಥವಾ ಗ್ರಾಹಿಗಳನ್ನು ಬಂಧಿಸಿ ಸಕ್ರಿಯಗೊಳಿಸುತ್ತವೆ. ಈ ಮೂಲಕ ಇವು ನರಕೋಶ-ಸಂವಹನೆಗೆ ಕಾರಣವಾಗುತ್ತವೆ
- ↑ ಬದುಕಿರುವ ಜೀವಿಯೊಂದರಲ್ಲಿ ಕಡಿಮೆ ಸರಳ ಅಥವಾ ಕಡಿಮೆ ಸಂಕೀರ್ಣ ಅಣುಗಳನ್ನು ಹೆಚ್ಚು ಸಂಕೀರ್ಣ ಅಣುಗಳಾಗಿ ಬದಲಾಯಿಸುವ ಪ್ರಕ್ರಿಯೆ
- ↑ ಒಂದು ಅಣುವಿನಲ್ಲಿ ಒಂದು ಪರಮಾಣುವಿನ ಸಾಮಾನ್ಯವಾಗಿ ಜಲಜನಕ ಪರಮಾಣುವಿನ ಯಾ ಪರಮಾಣು ಗುಚ್ಛದ ಸ್ಥಾನದಲ್ಲಿನ ಪರಮಾಣು ಯಾ ಪರಮಾಣುಗುಚ್ಛ
- ↑ ಸ್ಟೀರಿಯೊಐಸೊಮರ್ಗಳು ಎಂದು ಕರೆಯಲಾದ ಇವು ಸಮಾಂಗಿ ಅಥವಾ ಐಸೊಮರ್ ಅಣುಗಳು. ಇವಕ್ಕೆ ಒಂದೇ ಅಣು ಸೂತ್ರವಿರುತ್ತದೆ ಆದರೆ ಪರಮಾಣುಗಳ ಮೂರು ಆಯಾಮಗಳ ಸ್ಥಾನ ನಿರ್ಣಯದಲ್ಲಿ ಬೇರೆಯಾಗುತ್ತವೆ. ಸಾಮಾನ್ಯವಾಗಿ ಪ್ರಕೃತಿಯಲ್ಲಿ ಕಾಣಬರುವ ಅಮಿನೊ ಆಮ್ಲಗಳು “ಎಡಗೈಯ” ಸಮಾಂಗಿಗಳು. ಅಸಮಮಿತಿ ಅಥವಾ ಕೈರಲ್ ಗುಣ ಎಂದು ಕರೆಯಲಾದ ಇದರಲ್ಲಿ ಕನ್ನಡಿ ಪ್ರತಿಬಿಂಬ ಮೂಲದರಂತೆಯೇ ಇರುವುದಿಲ್ಲ.
- ↑ ೭.೦ ೭.೧ ಅಸಮಮಿತಿ ಅಥವಾ ಕೈರಲ್ ಗುಣ ಎಂದು ಕರೆಯಲಾದ ಇದರಲ್ಲಿ ಕನ್ನಡಿ ಪ್ರತಿಬಿಂಬ ಮೂಲದರಂತೆಯೇ ಇರುವುದಿಲ್ಲ.
- ↑ ಇನ್ನೊಂದು ಅಣುವಿನೊಂದಿಗೆ ಬಂಧಿಸಲ್ಪಟ್ಟು ಪಾಲಿಮರ್ ಆಗಬಲ್ಲ ಅಣು
- ↑ ಇದರ ಸಾಮಾನ್ಯ ಅರ್ಥ ಸಂಯುಕ್ತದ ರಾಸಾಯನಿಕ ಬಂಧ ಒಡೆದು ಎರಡೂ ಭಾಗಗಳಿಗೆ H ಮತ್ತು OH ಹಂಚಿಕೊಳ್ಳುವ ಕ್ರಿಯೆ
- ↑ ೧೦.೦ ೧೦.೧ -NH2 ಇಲ್ಲಿ ಅಮೈನ್ (ಆರಂಭದಲ್ಲಿನ ಅಮೈನ್ ಬಳಕೆ ನೋಡಿ) ಮತ್ತು ಅಮಿನೊ ಗುಂಪನ್ನು ಸಮಾನರ್ಥಕವಾಗಿ ಬಳಸಲಾಗಿದೆ. ಅಮಿನೊ ಗುಂಪು ಇರುವ ಸಾವಯವ ಅಣುವನ್ನು ಅಮೈನ್ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ ಎನ್ನುತ್ತದೆ. infoplease.com ಮಾಹಿತಿಗೆ ನೋಡಿ ಲಿಂಕ್ http://www.infoplease.com/encyclopedia/science/amino-group.html . ಇದು ಭಾಷೆಯ ಬಳಕೆಯ ರೀತಿಯಷ್ಟೆ ಎಂಬುದನ್ನು ಗಮನಿಸಿ
- ↑ ಎಂಟಿಯೊಮರ್ಗಳು- ಒಂದು ಇನ್ನೊಂದರ ಸಮನಲ್ಲದ ಕನ್ನಡಿ ಪ್ರತಿಬಿಂಬವಾಗಿರುತ್ತವೆ.
- ↑ repel ಪದಕ್ಕೆ ಅರ್ಥ. ನೋಡಿ -ನವಕರ್ನಾಟಕ ವಿಜ್ಞಾನ ಪದವಿವರಣ ಕೋಶ, ಪ್ರಧಾನ ಸಂಪಾದಕರು ಜಿ.ಟಿ.ನಾರಾಯಣರಾವ್, 2001, ನವಕರ್ನಾಟಕ ಪಬ್ಲಿಕೇಷನ್ಸ್ ಪ್ರೈವೆಟ್ ಲಿಮಿಟೆಡ್
- ↑ ೧೩.೦ ೧೩.೧ ಅಥವಾ ಅಮಿನೊಟ್ರಾನ್ಸ್ಫರೇಸ್ ಎಂದು ಕರೆಯಲಾದ ಈ ಕಿಣ್ವವು α-ಕೆಟೊ ಆಮ್ಲ ಮತ್ತು ಅಮಿನೊ ಆಮ್ಲಗಳ ನಡುವಿನ ಒಂದು ರೀತಿಯ ಪ್ರತಿಕ್ರಿಯೆಗೆ ಕಾರಣವಾಗುತ್ತದೆ
- ↑ ಹಲವು ಪ್ರಾಣಿಗಳಲ್ಲಿ ಈ ಚಕ್ರವು ಅಮೊನಿಯದಿಂದ (NH3) ಯೂರಿಯ ((NH2)2CO) ಉತ್ಪಾದಿಸುತ್ತದೆ.
- ↑ ಕಾರ್ಬೊಹೈಡ್ರೇಟ್ಗಳು, ಮೇಧಸ್ಸು ಮತ್ತು ಪ್ರೋಟೀನ್ಗಳು ಶಕ್ತಿಯಾಗಿ ಗ್ವಾನಿನ್ ಟ್ರೈಪಾಸ್ಪೇಟ್ (ಜಿಟಿಪಿ) ಮತ್ತು ಉಳಿಕೆಯಾಗಿ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ ಆಗುವ ಪ್ರಕ್ರಿಯೆ
- ↑ ಇದು ಔಷದಿಯ ಸಂಯುಕ್ತವು ಸುರಕ್ಷಿತವಾಗಿ ಗುಣಪಡಿಸುವ ಪರಿಣಾಮವನ್ನುಂಟು ಮಾಡಲು ದೇಹದೊಳಗಿನ ಸಾಗಣೆ ವ್ಯವಸ್ಥೆ
- ↑ ನ್ಯಾಪಿ ಎಂದು ಸಹ ಕರೆಯಲಾದ ಇದನ್ನು ಚಿಕ್ಕ ಮಕ್ಕಳು ಮತ್ತು ಹಾಸಿಗೆಯಲ್ಲಿ ಮೂತ್ರವಿಸರ್ಜನೆ ಮಾಡಿಕೊಳ್ಳುವವರಿಗೆ ಬಳಸಲಾಗುತ್ತದೆ. ಇದು ಮೂತ್ರವನ್ನು ಹಿಂಗಿಸಿಕೊಂಡು ಇತರ ಬಟ್ಟೆಗಳಿಗೆ ಹರಡದಂತೆ ಮಾಡುತ್ತದೆ. ಕಾಲಕಾಲಕ್ಕೆ ಇದನ್ನು ಬದಲಿಸ ಬೇಕು
- ↑ ೧೮.೦ ೧೮.೧ ಎಲೆಕ್ಟ್ರಾನು ಅಥವಾ ಎಲೆಕ್ಟ್ರಾನುಗಳನ್ನು ಪಡೆಯುವ ಮೂಲಕವಾಗಲಿ ಅಥವಾ ಕಳೆದುಕೊಳ್ಳುವ ಮೂಲಕವಾಗಲಿ ವಿದ್ಯುತ್ ಆವೇಶ ಪಡೆದ ಪರಮಾಣು
- ↑ ದ್ರವದ ಉಪ್ಪುಗಳು, ಆಕ್ಸೈಡ್ಗಳು ಮತ್ತು ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು ಹರಳುಗಟ್ಟುವುದು
- ↑ ಇದನ್ನು ಅನಿಲ ಅಥವಾ ದ್ರವದಲ್ಲಿ ಸೇರಿಸಿದಾಗ ಲೋಹವು ಅದರ ಆಕ್ಸೈಡ್, ಹೈಡ್ರಾಕ್ಸೈಡ್, ಪೆರಾಕ್ಸೈಡ್ ಆಗುವ ದರವನ್ನು ಕಡಿಮೆ ಮಾಡುತ್ತದೆ
ಉಲ್ಲೇಖಗಳು
[ಬದಲಾಯಿಸಿ]- ↑ "Amino". Dictionary.com. 2015. Retrieved 2015-07-03.
- ↑ "amino acid". Cambridge Dictionaries Online. Cambridge University Press. 2015. Retrieved 2015-07-03
- ↑ "amino". FreeDictionary.com. Farlex. 2015. Retrieved 2015-07-03.
- ↑ Wagner I, Musso H (November 1983). "New Naturally Occurring Amino Acids". Angewandte Chemie International Edition in English 22 (11): 816–28. doi:10.1002/anie.198308161.
- ↑ Latham, Michael C. (1997). "Chapter 8. Body composition, the functions of food, metabolism and energy". Human nutrition in the developing world. Food and Nutrition Series - No. 29. Rome: Food and Agriculture Organization of the United Nations.
- ↑ Proline is an exception to this general formula. It lacks the NH2 group because of the cyclization of the side-chain and is known as an imino acid; it falls under the category of special structured amino acids.
- ↑ Clark, Jim (August 2007). "an introduction to amino acids". chemguide. Retrieved 2015-07-04.
- ↑ "Chapter 1: Proteins are the Body's Worker Molecules". The Structures of Life. National Institute of General Medical Sciences. 27 October 2011. Retrieved 2008-05-20.
- ↑ Jakubke, Hans-Dieter; Sewald, Norbert (2008). "Amino acids". Peptides from A to Z: A Concise Encyclopedia. Germany: Wiley-VCH. p. 20. ISBN 9783527621170 – via Google Books.
- ↑ Pollegioni, Loredano; Servi, Stefano, eds. (2012). Unnatural Amino Acids: Methods and Protocols. Methods in Molecular Biology - Volume 794. Humana Press. p. v. ISBN 978-1-61779-331-8. OCLC 756512314.
- ↑ Hertweck C (2011). "Biosynthesis and Charging of Pyrrolysine, the 22nd Genetically Encoded Amino Acid". Angewandte Chemie International Edition 50 (41): 9540–1. doi:10.1002/anie.201103769. PMID 21796749.
- ↑ Michal, Gerhard; Schomburg, Dietmar, eds. (2012). Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (2nd ed.). Wiley. p. 5.
- ↑ Modeling Electrostatic Contributions to Protein Folding and Binding – Tjong, p.1 footnote
- ↑ Frontiers in Drug Design and Discovery ed. Atta-Ur-Rahman & others, p.299
- ↑ Elzanowski A, Ostell J (7 April 2008). "The Genetic Codes". National Center for Biotechnology Information (NCBI). Retrieved 10
- ↑ Xie J, Schultz PG (December 2005). "Adding amino acids to the genetic repertoire". Current Opinion in Chemical Biology 9 (6): 548–54. doi:10.1016/j.cbpa.2005.10.011. PMID 16260173.
- ↑ Wang Q, Parrish AR, Wang L (March 2009). "Expanding the genetic code for biological studies". Chem. Biol. 16 (3): 323–36. doi:10.1016/j.chembiol.2009.03.001. PMC 2696486. PMID 19318213.
- ↑ Simon M (2005). Emergent computation: emphasizing bioinformatics. New York: AIP Press/Springer Science+Business Media. pp. 105–106. ISBN 0-387-22046-1.
- ↑ Petroff OA (December 2002). "GABA and glutamate in the human brain". Neuroscientist 8 (6): 562–573. doi:10.1177/1073858402238515. PMID 12467378.
- ↑ For example, ruminants such as cows obtain a number of amino acids via microbes in the first two stomach chambers.
- ↑ Vauquelin LN, Robiquet PJ (1806). "The discovery of a new plant principle in Asparagus sativus". Annales de Chimie 57: 88–93.
- ↑ ೨೨.೦ ೨೨.೧ Anfinsen CB, Edsall JT, Richards FM (1972). Advances in Protein Chemistry. New York: Academic Press. pp. 99, 103. ISBN 978-0-12-034226-6.
- ↑ Wollaston WH (1810). "On cystic oxide, a new species of urinary calculus". Philosophical Transactions of the Royal Society 100: 223–30. doi:10.1098/rstl.1810.0015.
- ↑ Baumann E (1884). "Über cystin und cystein". Z Physiol Chem 8 (4): 299–305. Archived from the original on 14 March 2011. Retrieved 28 March 2011.
- ↑ Braconnot HM (1820). "Sur la conversion des matières animales en nouvelles substances par le moyen de l'acide sulfurique". Annales de Chimie et de Physique. 2nd Series 13: 113–25.
- ↑ Robert D. Simoni; Robert L. Hill; Martha Vaughan (September 13, 2002). "The Discovery of the Amino Acid Threonine: the Work of William C. Rose". Journal of Biological Chemistry 277 (37): 56–58. PMID 12218068.
- ↑ McCoy, R. H.; Meyer, C. E. & Rose, W. C. (1935). "Feeding Experiments with Mixtures of Highly Purified Amino Acids. VIII. Isolation and Identification of a New Essential Amino Acid". Journal of Biological Chemistry 112: 283–302.
- ↑ Joseph S. Fruton (1990). "Chapter 5- Emil Fischer and Franz Hofmeister". Contrasts in Scientific Style: Research Groups in the Chemical and Biochemical Sciences, 191. American Philosophical Society. pp. 163–165. ISBN 0-87169-191-4.
- ↑ "Alpha amino acid - Medical definition". Merriam-Webster dictionary.
- ↑ Proline at the US National Library of Medicine Medical Subject Headings (MeSH)
- ↑ "ಆರ್ಕೈವ್ ನಕಲು". Archived from the original on 2008-01-18. Retrieved 2016-07-04.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Imino acids".
- ↑ ೩೩.೦ ೩೩.೧ ೩೩.೨ Creighton, Thomas H. (1993). "Chapter 1". Proteins: structures and molecular properties. San Francisco: W. H. Freeman. ISBN 978-0-7167-7030-5.
- ↑ "Nomenclature and Symbolism for Amino Acids and Peptides". IUPAC-IUB Joint Commission on Biochemical Nomenclature. 1983. Archived from the original on 9 October 2008. Retrieved 17 November 2008.
- ↑ Rodnina MV, Beringer M, Wintermeyer W (January 2007). "How ribosomes make peptide bonds". Trends in Biochemical Sciences 32 (1): 20–6. doi:10.1016/j.tibs.2006.11.007. PMID 17157507.
- ↑ Driscoll DM, Copeland PR (2003). "Mechanism and regulation of selenoprotein synthesis". Annual Review of Nutrition 23 (1): 17–40. doi:10.1146/annurev.nutr.23.011702.073318. PMID 12524431.
- ↑ Krzycki JA (December 2005). "The direct genetic encoding of pyrrolysine". Current Opinion in Microbiology 8 (6): 706–12. doi:10.1016/j.mib.2005.10.009. PMID 16256420.
- ↑ Vermeer C (March 1990). "Gamma-carboxyglutamate-containing proteins and the vitamin K-dependent carboxylase". The Biochemical Journal 266 (3): 625–36. doi:10.1042/bj2660625. PMC 1131186. PMID 2183788.
- ↑ Bhattacharjee A, Bansal M (March 2005). "Collagen structure: the Madras triple helix and the current scenario". IUBMB Life 57 (3): 161–72. doi:10.1080/15216540500090710. PMID 16036578.
- ↑ Park MH (February 2006). "The post-translational synthesis of a polyamine-derived amino acid, hypusine, in the eukaryotic translation initiation factor 5A (eIF5A)". Journal of Biochemistry 139 (2): 161–9. doi:10.1093/jb/mvj034. PMC 2494880. PMID 16452303.
- ↑ Blenis J, Resh MD (December 1993). "Subcellular localization specified by protein acylation and phosphorylation". Current Opinion in Cell Biology 5 (6): 984–9. doi:10.1016/0955-0674(93)90081-Z. PMID 8129952.
- ↑ Curis E, Nicolis I, Moinard C, Osowska S, Zerrouk N, Bénazeth S, Cynober L (November 2005). "Almost all about citrulline in mammals". Amino Acids 29 (3): 177–205. doi:10.1007/s00726-005-0235-4. PMID 16082501.
- ↑ Coxon KM, Chakauya E, Ottenhof HH, Whitney HM, Blundell TL, Abell C, Smith AG (August 2005). "Pantothenate biosynthesis in higher plants". Biochemical Society Transactions 33 (Pt 4): 743–6. doi:10.1042/BST0330743. PMID 16042590.
- ↑ Ketchem, Randal R.; Hu, Weidong; Cross, Timothy A. (1993). "High-Resolution Conformation of Gramicidin A in a Lipid Bilayer by Solid-State NMR". Science 261: 1457–1460. doi:10.1126/science.7690158.
- ↑ Khoury, George A.; Baliban, Richard C.; Floudas, Christodoulos A. (2011). "Proteome-Wide Post-Translational Modification Statistics: Frequency Analysis and Curation of the Swiss-Prot Database". Scientific Reports 1 (90). doi:10.1038/srep00090. PMID 22034591.[[non-primary source needed]
- ↑ Sakami W, Harrington H (1963). "Amino acid metabolism". Annual Review of Biochemistry 32 (1): 355–98. doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484.
- ↑ Brosnan JT (April 2000). "Glutamate, at the interface between amino acid and carbohydrate metabolism". The Journal of Nutrition 130 (4S Suppl): 988S–90S. PMID 10736367.
- ↑ Young VR, Ajami AM (September 2001). "Glutamine: the emperor or his clothes?". The Journal of Nutrition 131 (9 Suppl): 2449S–59S; discussion 2486S–7S. PMID 11533293.
- ↑ Young VR (August 1994). "Adult amino acid requirements: the case for a major revision in current recommendations". The Journal of Nutrition 124 (8 Suppl): 1517S–1523S. PMID 8064412.
- ↑ Fürst P, Stehle P (June 2004). "What are the essential elements needed for the determination of amino acid requirements in humans?". The Journal of Nutrition 134 (6 Suppl): 1558S–1565S. PMID 15173430.
- ↑ Reeds PJ (July 2000). "Dispensable and indispensable amino acids for humans". The Journal of Nutrition 130 (7): 1835S–40S. PMID 10867060.
- ↑ Imura K, Okada A (January 1998). "Amino acid metabolism in pediatric patients". Nutrition 14 (1): 143–8. doi:10.1016/S0899-9007(97)00230-X. PMID 9437700.
- ↑ Lourenço R, Camilo ME (2002). "Taurine: a conditionally essential amino acid in humans? An overview in health and disease". Nutrición Hospitalaria 17 (6): 262–70. PMID 12514918.
- ↑ Savelieva KV, Zhao S, Pogorelov VM, Rajan I, Yang Q, Cullinan E, Lanthorn TH (2008). Bartolomucci A, ed. "Genetic disruption of both tryptophan hydroxylase genes dramatically reduces serotonin and affects behavior in models sensitive to antidepressants". PLOS ONE 3 (10): e3301. Bibcode:2008PLoSO...3.3301S. doi:10.1371/journal.pone.0003301. PMC 2565062. PMID 18923670.
- ↑ Hylin, John W. (1969). "Toxic peptides and amino acids in foods and feeds". Journal of Agricultural and Food Chemistry 17 (3): 492–6. doi:10.1021/jf60163a003.
- ↑ Turner BL, Harborne JB (1967). "Distribution of canavanine in the plant kingdom". Phytochemistry 6 (6): 863–66. doi:10.1016/S0031-9422(00)86033-1.
- ↑ Ekanayake S, Skog K, Asp NG (May 2007). "Canavanine content in sword beans (Canavalia gladiata): analysis and effect of processing". Food and Chemical Toxicology 45 (5): 797–803. doi:10.1016/j.fct.2006.10.030. PMID 17187914.
- ↑ Rosenthal GA (2001). "L-Canavanine: a higher plant insecticidal allelochemical". Amino Acids 21 (3): 319–30. doi:10.1007/s007260170017. PMID 11764412.
- ↑ Leuchtenberger W, Huthmacher K, Drauz K (November 2005). "Biotechnological production of amino acids and derivatives: current status and prospects". Applied Microbiology and Biotechnology 69 (1): 1–8. doi:10.1007/s00253-005-0155-y. PMID 16195792.
- ↑ Ashmead, H. DeWayne (1993). The Role of Amino Acid Chelates in Animal Nutrition. Westwood: Noyes Publications.
- ↑ Garattini S (April 2000). "Glutamic acid, twenty years later". The Journal of Nutrition 130 (4S Suppl): 901S–9S. PMID 10736350.
- ↑ Stegink LD (July 1987). "The aspartame story: a model for the clinical testing of a food additive". The American Journal of Clinical Nutrition 46 (1 Suppl): 204–15. PMID 3300262.
- ↑ Albion Laboratories, Inc. "Albion Ferrochel Website". Retrieved 12 July 2011.
- ↑ Ashmead, H. DeWayne (1986). Foliar Feeding of Plants with Amino Acid Chelates. Park Ridge: Noyes Publications.
- ↑ Turner EH, Loftis JM, Blackwell AD (March 2006). "Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan". Pharmacology & Therapeutics 109 (3): 325–38. doi:10.1016/j.pharmthera.2005.06.004. PMID 16023217.
- ↑ Kostrzewa RM, Nowak P, Kostrzewa JP, Kostrzewa RA, Brus R (March 2005). "Peculiarities of L: -DOPA treatment of Parkinson's disease". Amino Acids 28 (2): 157–64. doi:10.1007/s00726-005-0162-4. PMID 15750845.
- ↑ Heby O, Persson L, Rentala M (August 2007). "Targeting the polyamine biosynthetic enzymes: a promising approach to therapy of African sleeping sickness, Chagas' disease, and leishmaniasis". Amino Acids 33 (2): 359–66. doi:10.1007/s00726-007-0537-9. PMID 17610127.
- ↑ Sanda F, Endo T (1999). "Syntheses and functions of polymers based on amino acids". Macromolecular Chemistry and Physics 200 (12): 2651–61. doi:10.1002/(SICI)1521-3935(19991201)200:12<2651::AID-MACP2651>3.0.CO;2-P.
- ↑ Gross RA, Kalra B (2002). "Biodegradable Polymers for the Environment". Science 297 (5582): 803–807. Bibcode:2002Sci...297..803G. doi:10.1126/science.297.5582.803. PMID 12161646.
- ↑ Low, K. C.; Wheeler, A. P.; Koskan, L. P. (1996). Commercial poly(aspartic acid) and Its Uses. Advances in Chemistry Series 248. Washington, D.C.: American Chemical Society.
- ↑ Thombre SM, Sarwade BD (2005). "Synthesis and Biodegradability of Polyaspartic Acid: A Critical Review" (PDF). Journal of Macromolecular Science, Part A 42 (9): 1299–1315. doi:10.1080/10601320500189604.
- ↑ Bourke SL, Kohn J (2003). "Polymers derived from the amino acid l-tyrosine: polycarbonates, polyarylates and copolymers with poly(ethylene glycol)". Advanced Drug Delivery Reviews 55 (4): 447–466. doi:10.1016/S0169-409X(03)00038-3. PMID 12706045.
- ↑ Jones, Russell Celyn; Buchanan, Bob B.; Gruissem, Wilhelm (2000). Biochemistry & molecular biology of plants. Rockville, Md: American Society of Plant Physiologists. pp. 371–2. ISBN 0-943088-39-9.
- ↑ Brosnan JT, Brosnan ME (June 2006). "The sulfur-containing amino acids: an overview". The Journal of Nutrition 136 (6 Suppl): 1636S–1640S. PMID 16702333.
- ↑ Kivirikko KI, Pihlajaniemi T (1998). "Collagen hydroxylases and the protein disulfide isomerase subunit of prolyl 4-hydroxylases". Advances in Enzymology and Related Areas of Molecular Biology. Advances in Enzymology - and Related Areas of Molecular Biology 72: 325–98. doi:10.1002/9780470123188.ch9. ISBN 9780470123188. PMID 9559057.
- ↑ Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. (2002). Biochemistry. San Francisco: W.H. Freeman. pp. 639–49. ISBN 0-7167-4684-0.
- ↑ ೭೭.೦ ೭೭.೧ ೭೭.೨ ೭೭.೩ Hausman, Robert E.; Cooper, Geoffrey M. (2004). The cell: a molecular approach. Washington, D.C: ASM Press. p. 51. ISBN 0-87893-214-3.
- ↑ "ಆರ್ಕೈವ್ ನಕಲು". Archived from the original on 2016-05-30. Retrieved 2016-07-04.
